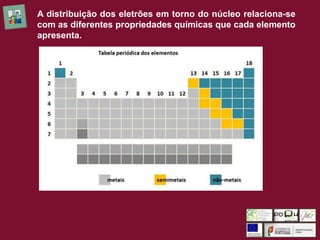
O documento discute as propriedades químicas dos elementos na tabela periódica. Apresenta as características dos metais, não metais, semimetais e gases nobres. Explica que a reatividade dos metais alcalinos e halogênios aumenta ao longo de seus respectivos grupos devido à distância do elétron de valência ao núcleo. Quanto maior essa distância, maior a tendência do elétron em ser perdido, aumentando a reatividade dos metais alcalinos; quanto menor a distância, maior a atração do n