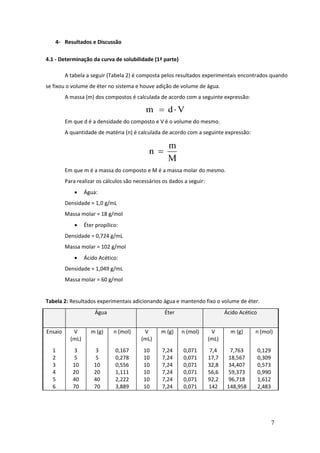
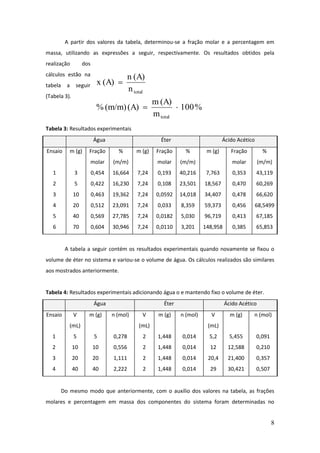
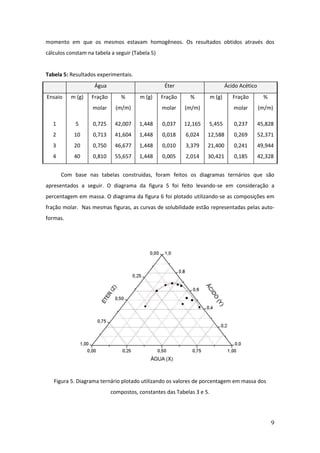
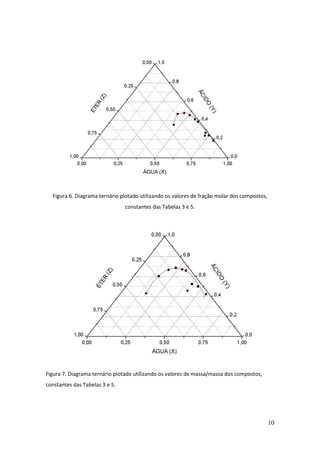
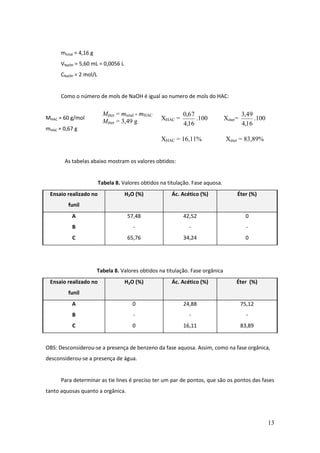
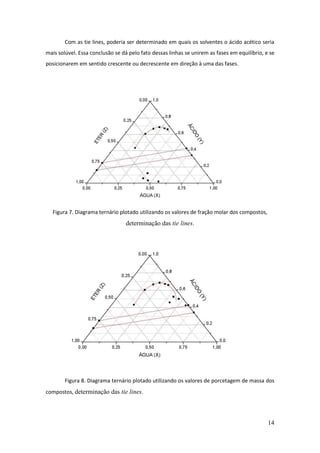
Este documento descreve um experimento de laboratório sobre equilíbrio heterogêneo em sistemas ternários. O objetivo era estudar a solubilidade de dois líquidos parcialmente miscíveis (água e éter) com um terceiro completamente miscível (ácido acético) através da construção de um diagrama de fases. O método envolvia determinar a curva de solubilidade adicionando volumes conhecidos de ácido acético até a solução ficar homogênea para diferentes quantidades de água.