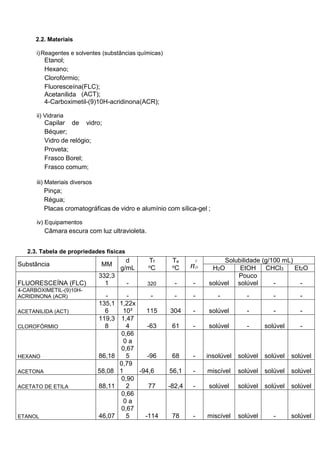
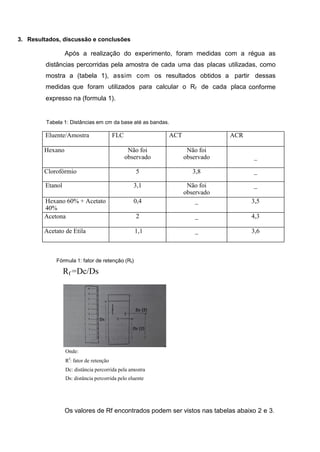
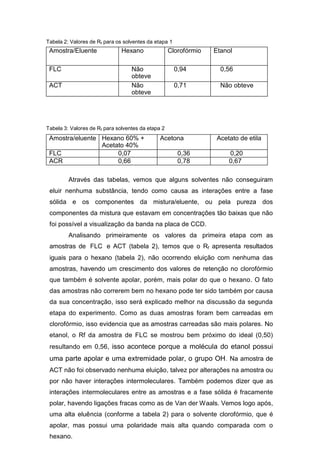
Este relatório descreve experimentos de cromatografia em camada delgada (CCD) realizados para separar misturas de compostos orgânicos e determinar seus fatores de retenção (Rf). Os experimentos compararam a eluição da fluoresceína e acetanilida, e depois fluoresceína e outra substância, usando diferentes solventes móveis. Os valores de Rf obtidos forneceram informações sobre a polaridade relativa dos compostos.