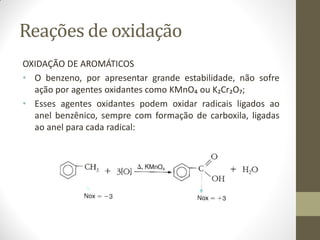
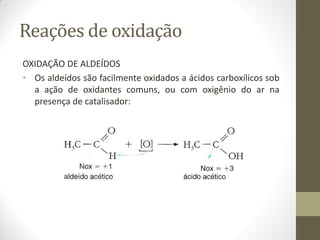
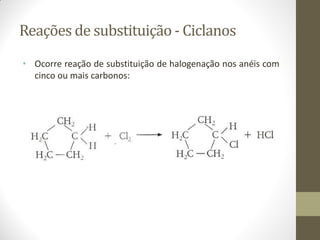
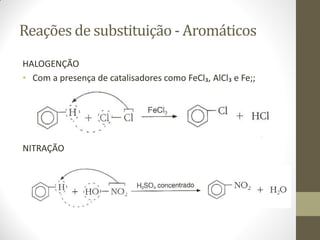
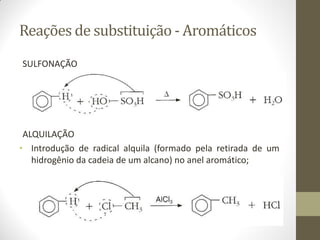
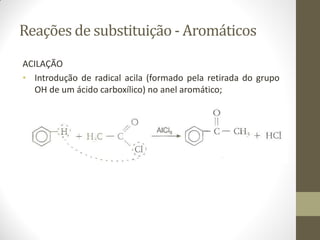
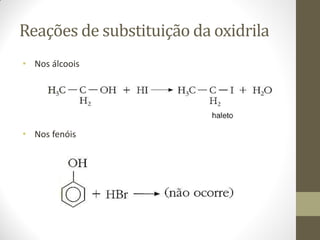
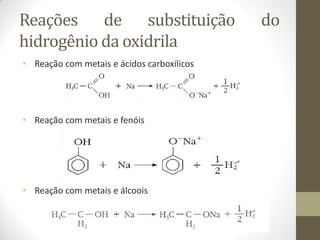
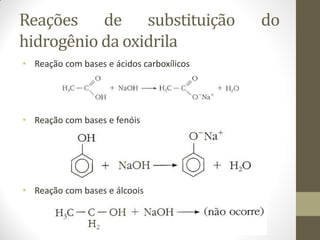
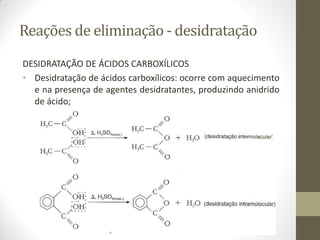
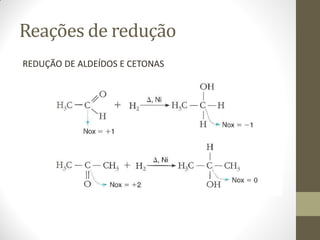
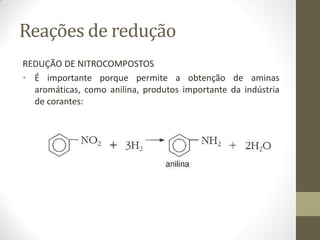
O documento resume as principais reações orgânicas, incluindo reações de adição, substituição, eliminação, redução, oxidação e polimerização. É explicado como cada tipo de reação ocorre e quais compostos orgânicos são afetados, como alcenos, alcinos, aromáticos, álcoois e outros.








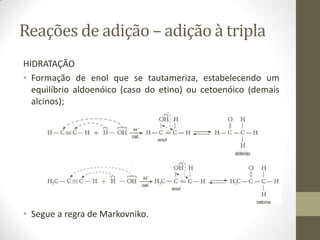







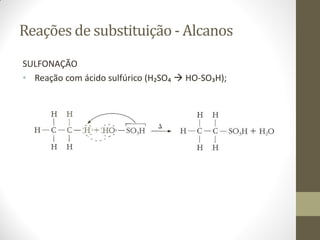
















![Reações de oxidação
• São reações que ocorrem com a entrada de oxigênio na
molécula ou saída de hidrogênios;
OXIDAÇÃO BRANDA
• É obtida usando-se uma solução uma solução diluída, neutra
ou levemente básica, de KMnO₄ - reativo de Baeyer;
• Nos alcenos: chamada de branda porque só há rompimento
de uma ligação da dupla no alceno:
• O símbolo [O] indica o emprego de um agente oxidante.](https://image.slidesharecdn.com/aula12-220918234246-52add7f0/85/Reacoes-organicas-44-320.jpg)