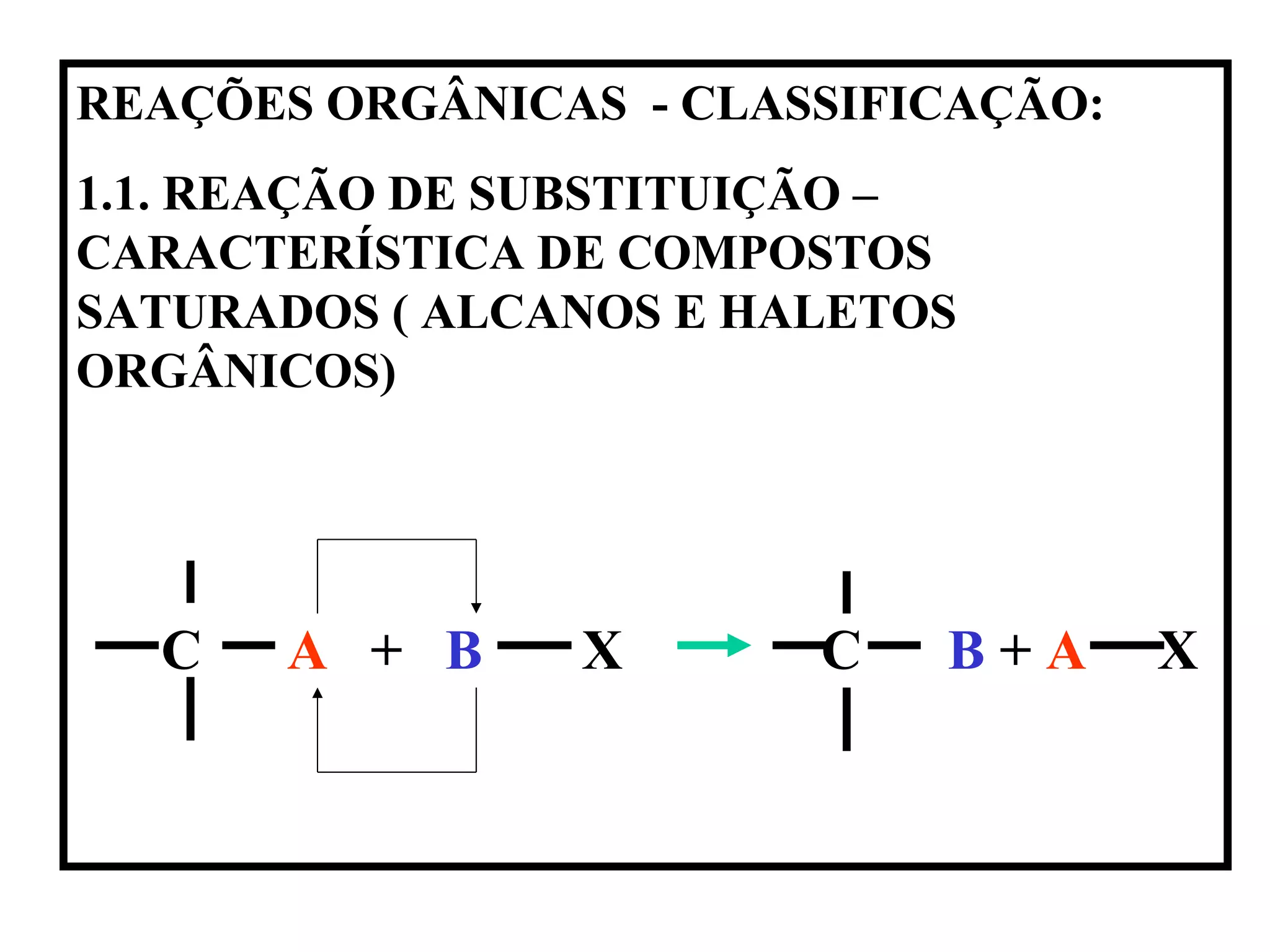
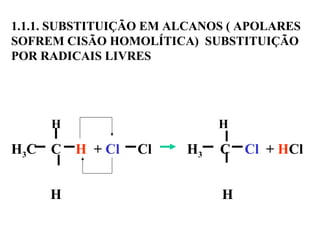
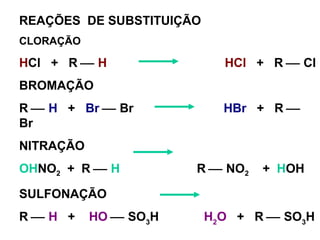
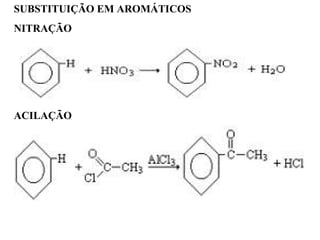
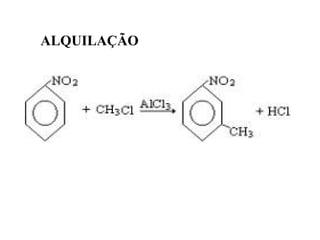
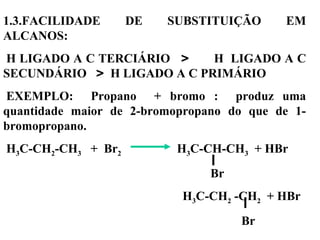
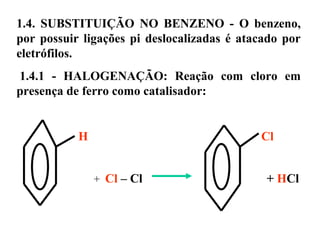
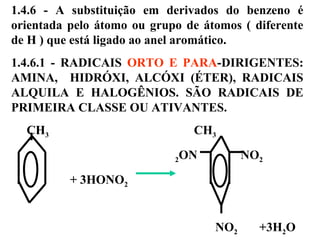
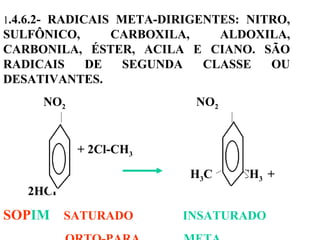
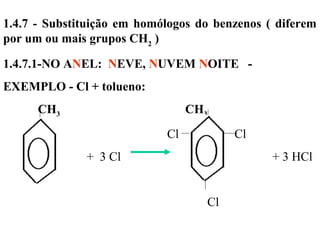
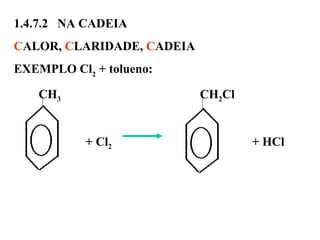
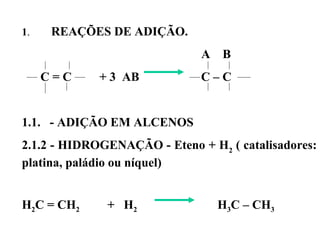
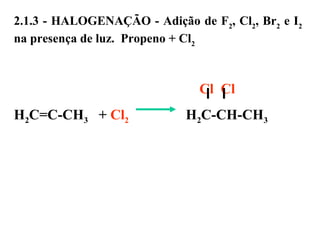
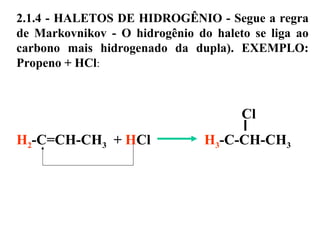
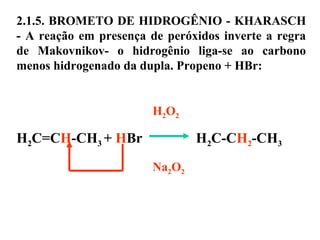
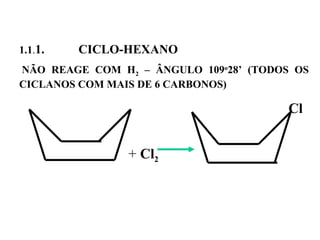
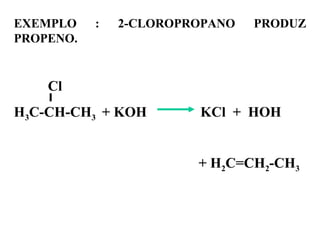
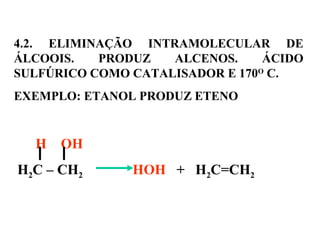
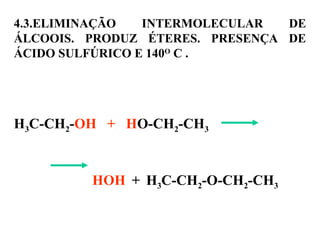
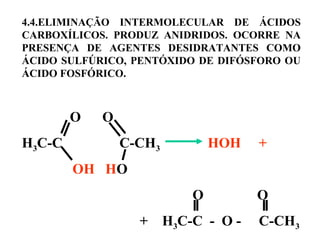
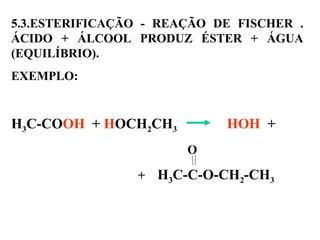
1. O documento descreve as principais reações orgânicas, classificando-as em reações de substituição, adição, eliminação e oxidação/redução. 2. Apresenta exemplos de como cada tipo de reação ocorre em compostos como alcanos, aromáticos e alcenos. 3. Discorre sobre fatores que influenciam a seletividade dessas reações, como a natureza dos substituintes no benzeno e a posição dos átomos de hidrogênio em alcanos.






![5.6.OXIDAÇÃO E REDUÇÃO. OXIDAÇÃO -
AÇÃO DO [O]. REDUÇÃO - AÇÃO DO [H].
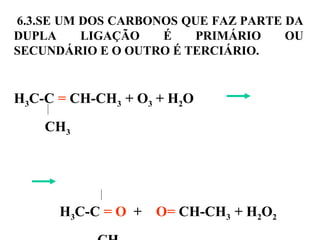
5.6.1. OZONÓLISE DE ALCENOS - SE AMBOS
OS CARBONOS DA DUPLA SÃO PRIMÁRIOS
OU SECUNDÁRIOS PRODUZ ALDEÍDOS.
H2C=CH-CH3 + O3 + H2O
H-C=O + O=C-CH3 + H2O2
H H](https://image.slidesharecdn.com/180-130731225514-phpapp02/85/180-36-320.jpg)

![7.OXIDAÇÃO BRANDA - OCORRE COM
PERMANGANATO DE POTÁSSIO EM MEIO
BÁSICO. NA OXIDAÇÃO BRANDA, APENAS A
LIGAÇÃO PI É ROMPIDA SENDO SUBSTITUÍDA
POR LIGAÇÕES SIGMAS FEITAS COM GRUPOS
-OH.
7.1. ALCENO PRODUZ DIOL VICINAL.
KMnO4
H2C = CH2 +2[O] H2C – CH2
H2O/OH-
OH OH](https://image.slidesharecdn.com/180-130731225514-phpapp02/85/180-39-320.jpg)
![7.2.ETINO PRODUZ ETANODIAL KMnO4/BÁSICO
H-C = C-H + 4[O] O = C – C = O +
H H
+ H2O2](https://image.slidesharecdn.com/180-130731225514-phpapp02/85/180-40-320.jpg)
![7.3. ALCINO COM TRIPLA ENTRE CARBONOS
SECUNDÁRIOS PRODUZ DICETONA (DIONA).
KMnO4/BÁSICO O O
H3C-C=C-CH3 + 4[O] H3C – C – C - CH3
+ 2 H2O.](https://image.slidesharecdn.com/180-130731225514-phpapp02/85/180-41-320.jpg)
![7.4. ALCINO COM TRIPLA ENTRE CARBONOS
PRIMÁRIO E SECUNDÁRIO PRODUZ ALDEÍDO-
CETONA (FUNÇÃO MISTA).
KMnO4/BÁSICO O
H3C-C=CH + 4[O] H3C-C-C=O + 2H2O
H
Básico
Branda](https://image.slidesharecdn.com/180-130731225514-phpapp02/85/180-42-320.jpg)
![8. OXIDAÇÃO ENÉRGICA - OCORRE COM
PERMANGANATO DE POTÁSSIO EM MEIO ÁCIDO
HÁ RUPTURA DA CADEIA.
8.1. DUPLA EM CARBONO PRIMÁRIO. PRODUZ
ÁCIDO CARBÔNICO QUE SE DECOMPÕE EM
ÁGUA E GÁS CARBÔNICO.
H-C = C-H + 6 [O] 2H2CO3 2CO2 + 2H2O
Enérgica](https://image.slidesharecdn.com/180-130731225514-phpapp02/85/180-43-320.jpg)
![8.2. DUPLA EM CARBONO SECUNDÁRIO
PRODUZ ÁCIDO CARBOXÍLICO.
KMnO4/H+
H3C-C=C-CH3 + 4[O] 2 H3C-COOH](https://image.slidesharecdn.com/180-130731225514-phpapp02/85/180-44-320.jpg)
![8.3. DUPLA EM CARBONO TERCIÀRIO PRODUZ
CETONA.
KMnO4/H+
H3C - C = C - CH3 + 2[O] 2H3C - C = O
CH3 CH3 CH3](https://image.slidesharecdn.com/180-130731225514-phpapp02/85/180-45-320.jpg)
![9. OXIDAÇÃO DE ÁLCOOIS. O DICROMATO
DE POTÁSSIO EM MEIO ÁCIDO É MUITO
USADO NA OXIDAÇÃO BRANDA DE ÁLCOOIS.
9.1. METANOL - OXIDAÇÃO PARCIAL
PRODUZ METANAL E ÁCIDO METANÓICO. A
TOTAL PRODUZ GÁS CARBÔNICO E ÁGUA.
H3C-OH + 3[O] H2O + HC=O +[O]
H
H-COOH H2O + CO2
OXIDAÇÃO DE ÁLCOOIS: K2Cr2O7/H+](https://image.slidesharecdn.com/180-130731225514-phpapp02/85/180-46-320.jpg)
![9.2. ÁLCOOL PRIMÁRIO. PARCIAL PRODUZ
ALDEÍDO E TOTAL ÁCIDO CARBOXÍLICO.
K2Cr2O7/H+
H3C-CH2OH + [O] H2O + H3C-C=O
H
K2Cr2O7/H+
H3C-C=O + [O] H3C-COOH
H](https://image.slidesharecdn.com/180-130731225514-phpapp02/85/180-47-320.jpg)
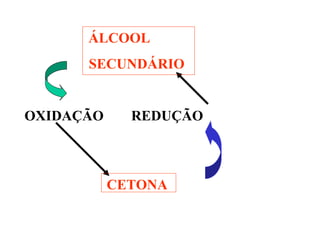
![9.3. ÁLCOOL SECUNDÁRIO. A OXIDAÇÃO
TOTAL PRODUZ CETONA.
OH K2Cr2O7/H+
O
H3C–C–CH3 + [O] H3C–C–CH3 + H2O](https://image.slidesharecdn.com/180-130731225514-phpapp02/85/180-48-320.jpg)
![9.4. O ÁLCOOL TERCIÁRIO NÃO OXIDA
OH
H3C–C–CH3 + [O] NÃO REAGE
CH3](https://image.slidesharecdn.com/180-130731225514-phpapp02/85/180-49-320.jpg)
![10.REDUÇÃO DE ÁCIDOS, ALDEÍDOS E
CETONAS. OCORRE COM ZINCO EM PRESENÇA
DE ÁCIDO CLORÍDRICO.
10.1. ALDEÍDO. REDUÇÃO TOTAL PRODUZ
ÁLCOOL PRIMÁRIO
H3C-C=O + 2[H] H3C-CH2-OH
H](https://image.slidesharecdn.com/180-130731225514-phpapp02/85/180-50-320.jpg)
![10.2. ÁCIDO CARBOXÍLICO. REDUÇÃO
PARCIAL PRODUZ ALDEÍDO E TOTAL ÁLCOOL
PRIMÁRIO.
H3C-C=O + 2[H] H2O + H3C-C=O +2[H]
OH H
H3C-CH2-OH](https://image.slidesharecdn.com/180-130731225514-phpapp02/85/180-51-320.jpg)
![10.3. CETONA. REDUÇÃO TOTAL PRODUZ
ÁLCOOL SECUNDÁRIO.
O OH
H3C-C-CH3 + 2[H] H3C-C-CH3](https://image.slidesharecdn.com/180-130731225514-phpapp02/85/180-53-320.jpg)