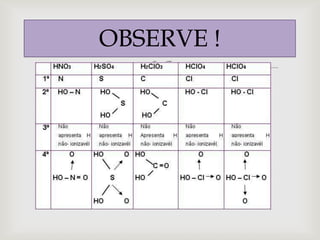
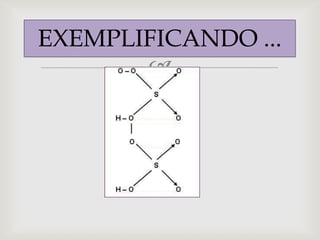
O documento discute diferentes tipos de fórmulas químicas, incluindo fórmulas estruturais e eletrônicas. Ele explica como transformar fórmulas estruturais em eletrônicas substituindo ligações por pares de elétrons. O documento também fornece exemplos de fórmulas para ácidos como ácido clorídrico e discute regras para escrever fórmulas de oxoácidos.