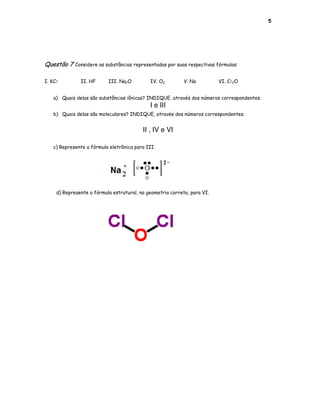
Este documento apresenta 7 questões sobre conceitos de química geral como ligações químicas, polaridade, tipos de substâncias e suas propriedades. As questões abordam tópicos como representação de fórmulas estruturais e eletrônicas, identificação do tipo de substância a partir de propriedades, e explicação de resultados experimentais com base nos modelos de ligação.