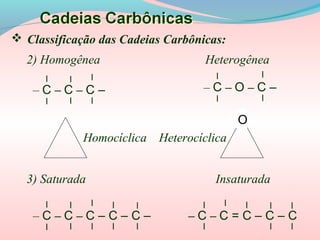
O documento fornece uma introdução à química orgânica, definindo-a como o estudo dos compostos de carbono. Explica as principais características dos compostos orgânicos e apresenta uma classificação detalhada das cadeias carbônicas e das principais funções orgânicas, como hidrocarbonetos, funções oxigenadas e nitrogenadas.











![FUNÇÕES OXIGENADAS
R – O – R’
R – C = O
O]–
cátion
R – C = O
Cl
R – C = O
O
R’– C = O
R – C = O
O – R’
Fórmula geral
H3C – O – CH3– O –Éter
H3C– C = O
Cl
– C = O
Cl
Cloreto de
ácido
H3C – C = O
ONa
– C = O
O]–
cátion
Sal orgânico
– C = O
O
– C = O
– C = O
O –
Grupo funcional
Anidrido
Éster
FUNÇÃO
H3C – C = O
O
H3C – C = O
H3C – C = O
O – CH3
Exemplos
/
/
/
](https://image.slidesharecdn.com/quimicaorganica-101027060934-phpapp01/85/Quimica-organica-13-320.jpg)
