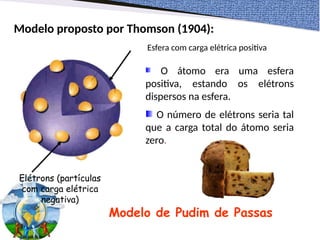
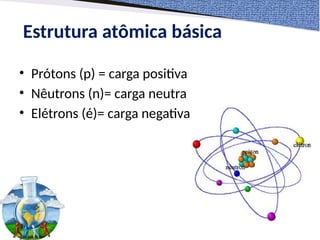
O documento aborda diferentes modelos atômicos propostos ao longo da história, desde as ideias de Demócrito e Leucipo até os desenvolvimentos de Thomson, Rutherford e Bohr. Cada modelo reflete avanços na compreensão da estrutura atômica, culminando com a compreensão quântica dos elétrons. A estrutura básica do átomo é descrita em termos de prótons, nêutrons e elétrons, com suas respectivas cargas e características.