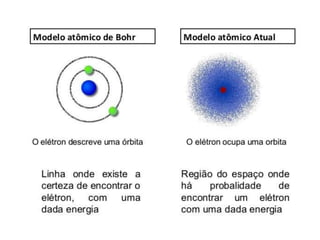
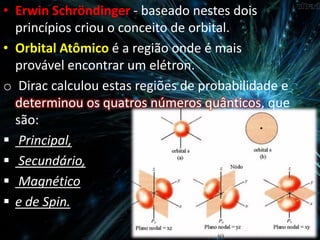
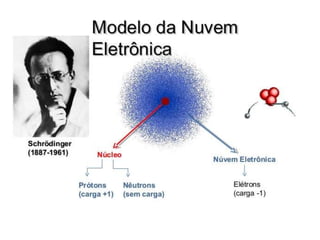
O documento descreve o modelo atômico atual baseado nos princípios da incerteza de Heisenberg e da dualidade da matéria de Broglie. Explica que Schrödinger criou o conceito de orbital e que Dirac calculou as quatro números quânticos que descrevem a localização e propriedades de um elétron: principal, secundário, magnético e de spin.