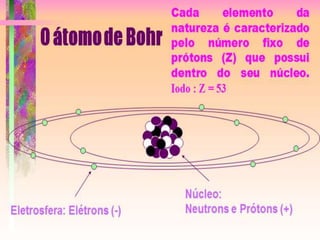
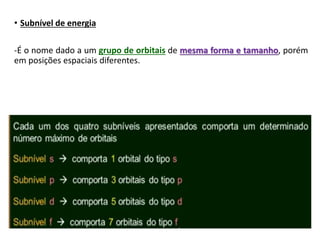
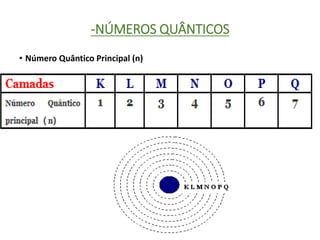
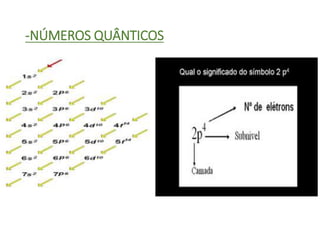
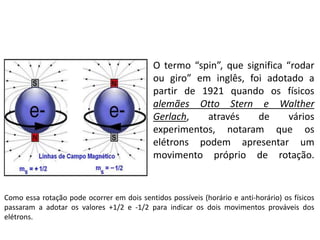
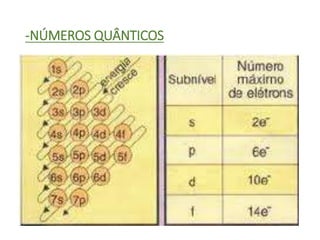
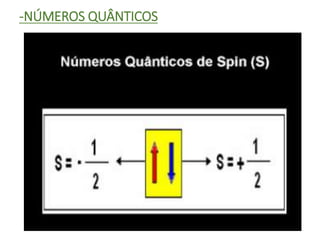
O documento discute os números quânticos e sua aplicação na descrição da estrutura eletrônica dos átomos. Explica os números quânticos principal, secundário, magnético e de spin, além de apresentar exercícios sobre a distribuição eletrônica de diferentes elementos químicos.