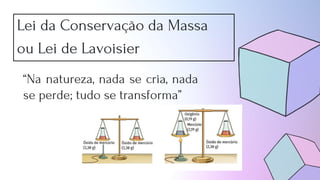
O documento discute os fundamentos da química como ciência, incluindo as leis da conservação da massa e das proporções fixas. Apresenta os conceitos de sistema aberto, fechado e isolado e descreve a teoria atômica de Dalton, que explicou essas leis com base na ideia de que os elementos químicos são constituídos de átomos.