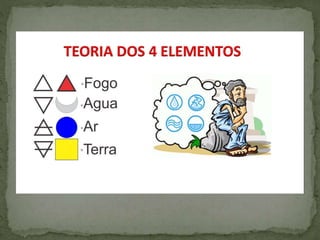
O documento descreve a história da química desde suas origens na pré-história até o desenvolvimento da química moderna. Aborda os principais conceitos e descobertas ao longo dos séculos, incluindo a teoria dos quatro elementos de Aristóteles, o surgimento da alquimia e da química quantitativa com Robert Boyle, e o estabelecimento das leis da conservação da massa e das proporções constantes por Lavoisier e Proust.