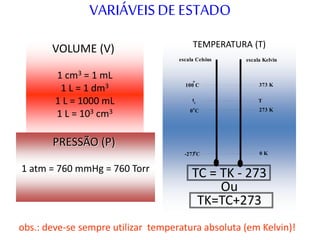
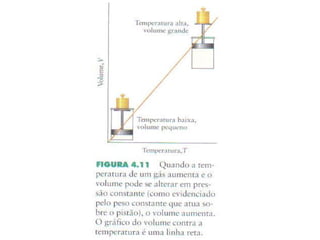
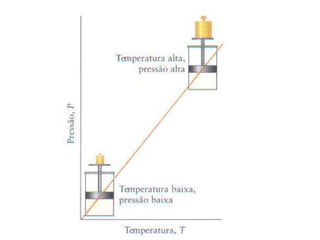
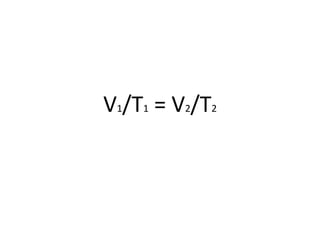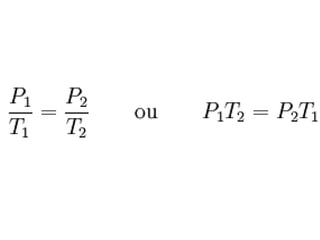1) O documento discute as leis dos gases de Boyle-Mariotte, Charles e Gay-Lussac, que descrevem a relação entre pressão, volume e temperatura em gases.
2) É apresentada a equação geral que relaciona essas variáveis em diferentes condições.
3) Exemplos ilustram cálculos envolvendo a aplicação dessas leis em problemas químicos e físicos.