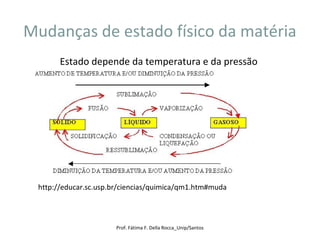
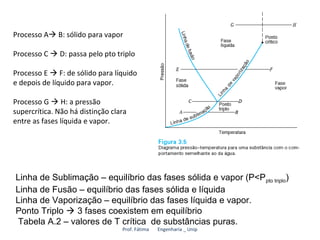
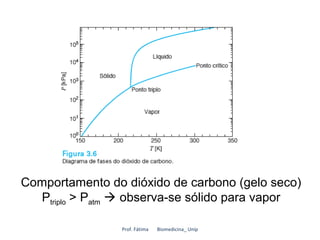
O documento discute os estados de agregação da matéria e as mudanças entre esses estados causadas por variações de temperatura e pressão. Os três estados principais são sólido, líquido e vapor, e a transição entre eles ocorre por processos como fusão, vaporização e sublimação. A temperatura e pressão necessárias para as transições dependem da substância em questão.