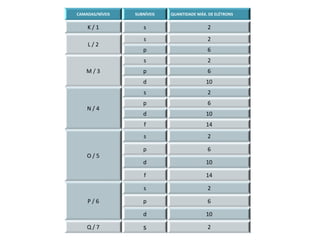
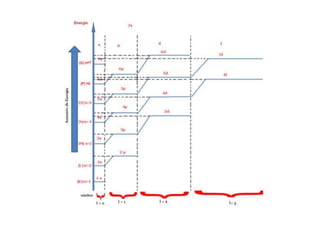
Este documento discute os modelos atômicos, distribuição eletrônica e números quânticos. Explica que os elétrons se comportam como partículas e ondas, e que orbitais são regiões de espaço onde há maior probabilidade de encontrar elétrons. Detalha como os elétrons são distribuídos em níveis e subníveis de energia, e fornece exemplos. Também define os números quânticos e como identificar elétrons usando esses números.