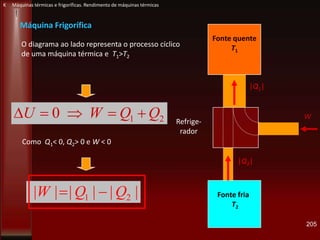
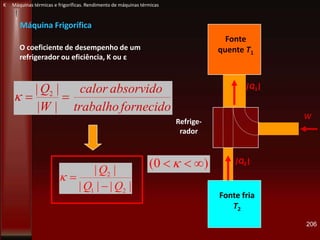
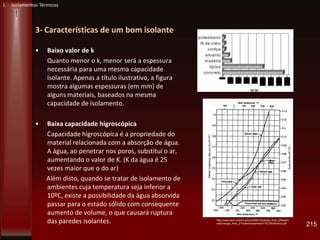
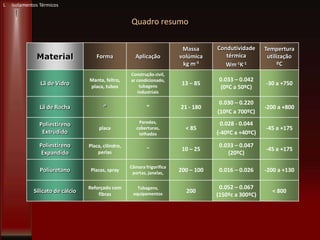
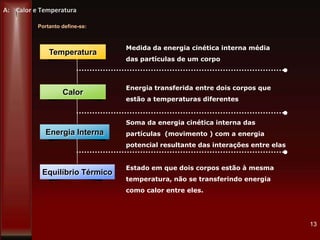
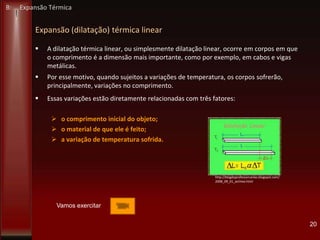
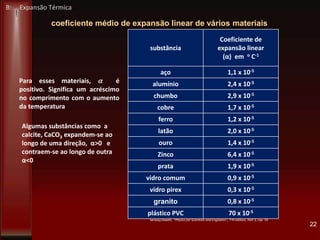
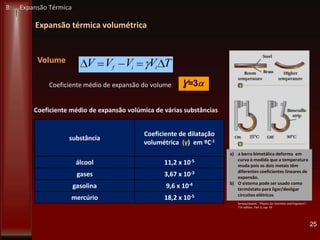
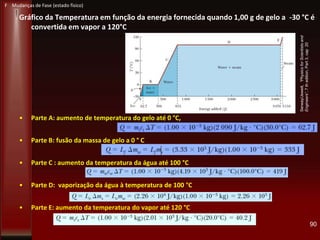
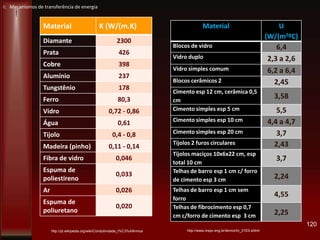
Este documento fornece instruções sobre como instalar uma apresentação sobre transferência de calor em um computador e descreve os objetivos e conteúdos da aprendizagem sobre este tema. O documento aborda conceitos como calor, temperatura, expansão térmica, mecanismos de transferência de calor e permutadores de calor.
















































































































![Um pouco de história
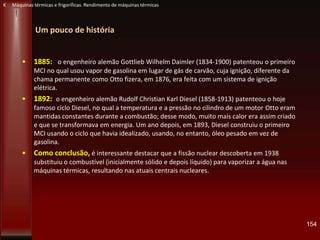
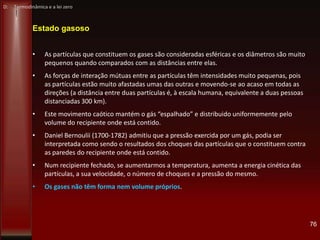
• 1765: o engenheiro escocês James Watt (1736-1819), contornou o problema da máquina de
Newcomen ao inventar o condensador – um dispositivo isolado para arrefecer o vapor de
água – e adaptá-lo à máquina de Newcomen. Em 1769, Watt patenteou a sua invenção e
começou a comercializá-la. Além disso, continuou o seu aperfeiçoamento.
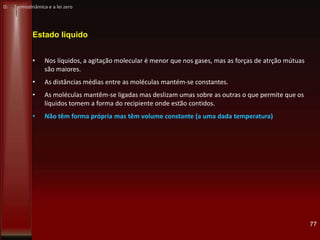
• 1782: Watt abandonou o uso da pressão atmosférica para baixar os pistões, e passou,
então, a utilizar o próprio vapor para realizar essa tarefa. Desse modo, o vapor entrava
alternativamente nas duas extremidades do pistão, e este, portanto, tanto empurrava como
aspirava o vapor. Em vista disso, esse seu novo invento ficou conhecido como máquina de
ação dupla
• 1783; Watt introduziu a definição de cavalo-vapor (CV) *“horse-power” (HP)], ao usar um
robusto cavalo e mostrar que ele poderia elevar à altura aproximada de 1,20 m, um peso de
68 kg num segundo. Hoje, essa unidade de potência, no sistema Internacional recebe o
nome de watt, em sua homenagem.
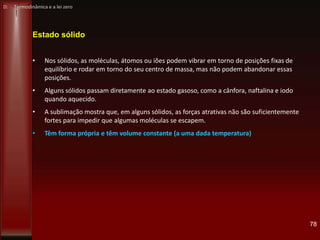
• 1803: o general e engenheiro militar francês Lazare Nicolas Marguerite Carnot (1753-
1823) estudou o baixo rendimento das máquinas a vapor (5-7%) usando o conceito de
energia potencial.
151
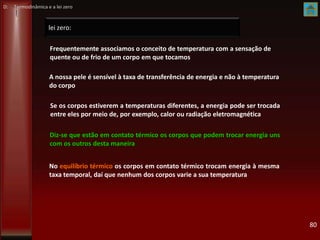
K Máquinas térmicas e frigoríficas. Rendimento de máquinas térmicas](https://image.slidesharecdn.com/mod5-transferencia-de-calor-vs2013-2014-130720070421-phpapp01/85/Mod-5-transferencia-de-calor-vs-2013-2014-151-320.jpg)