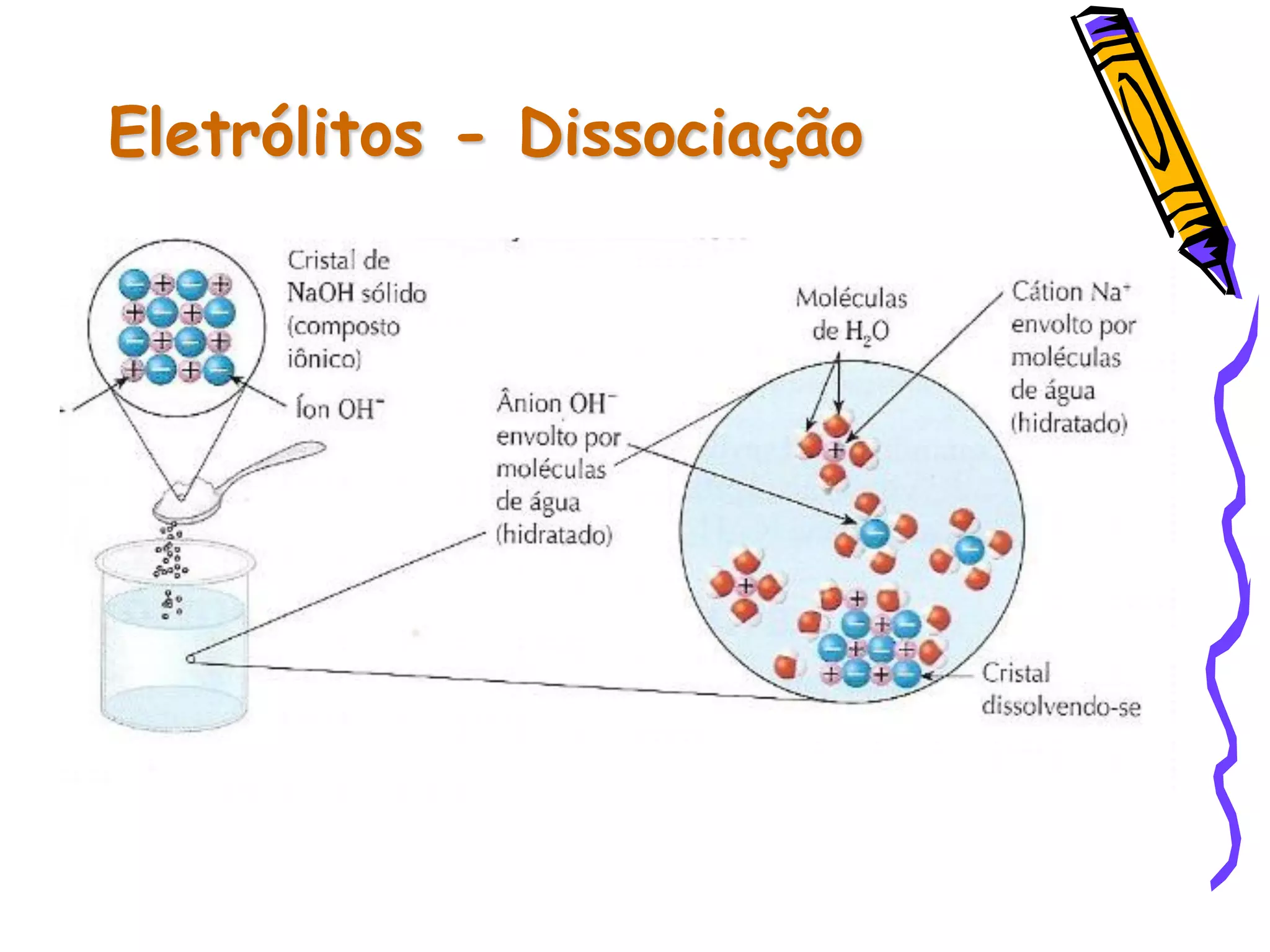
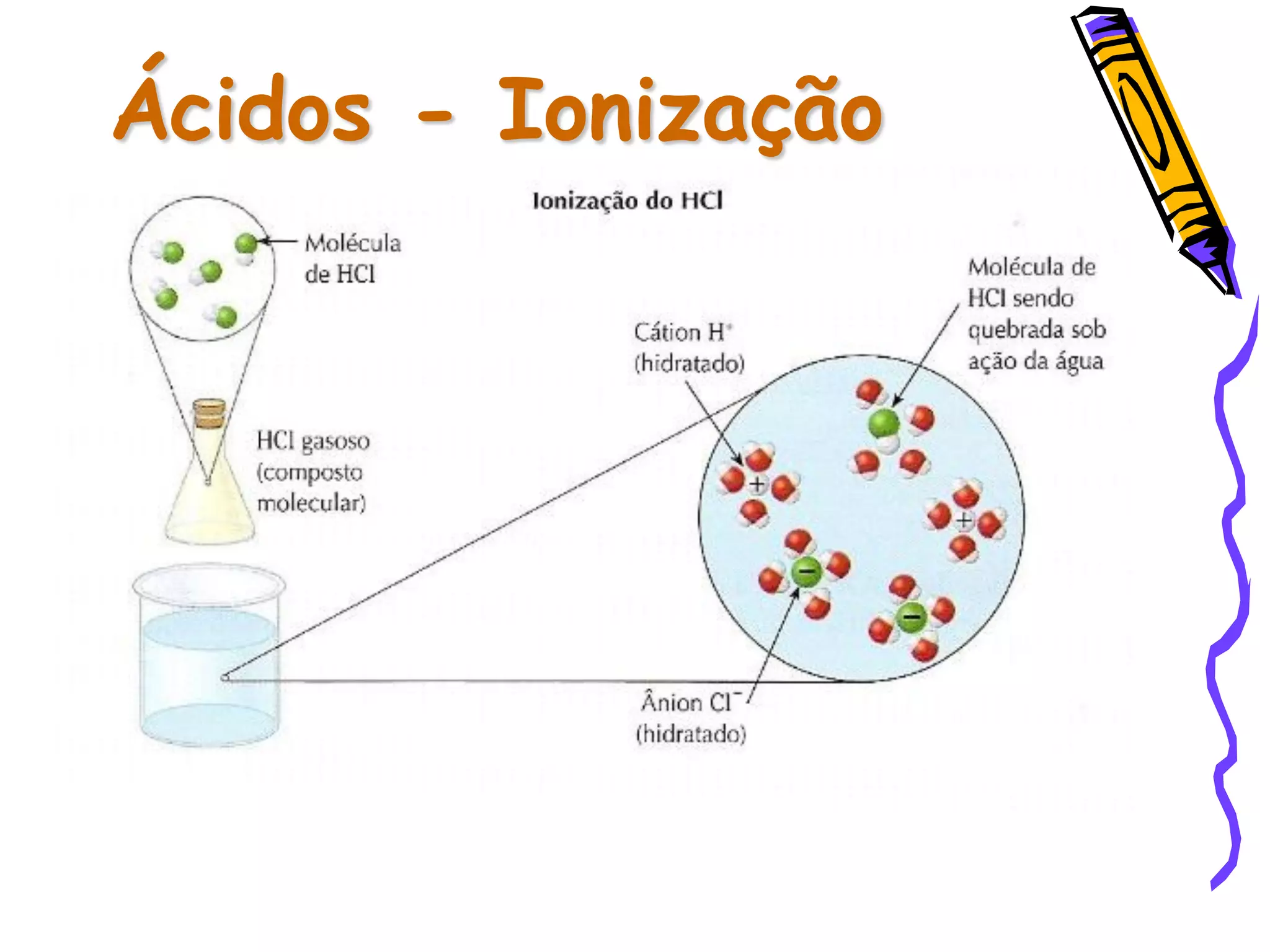
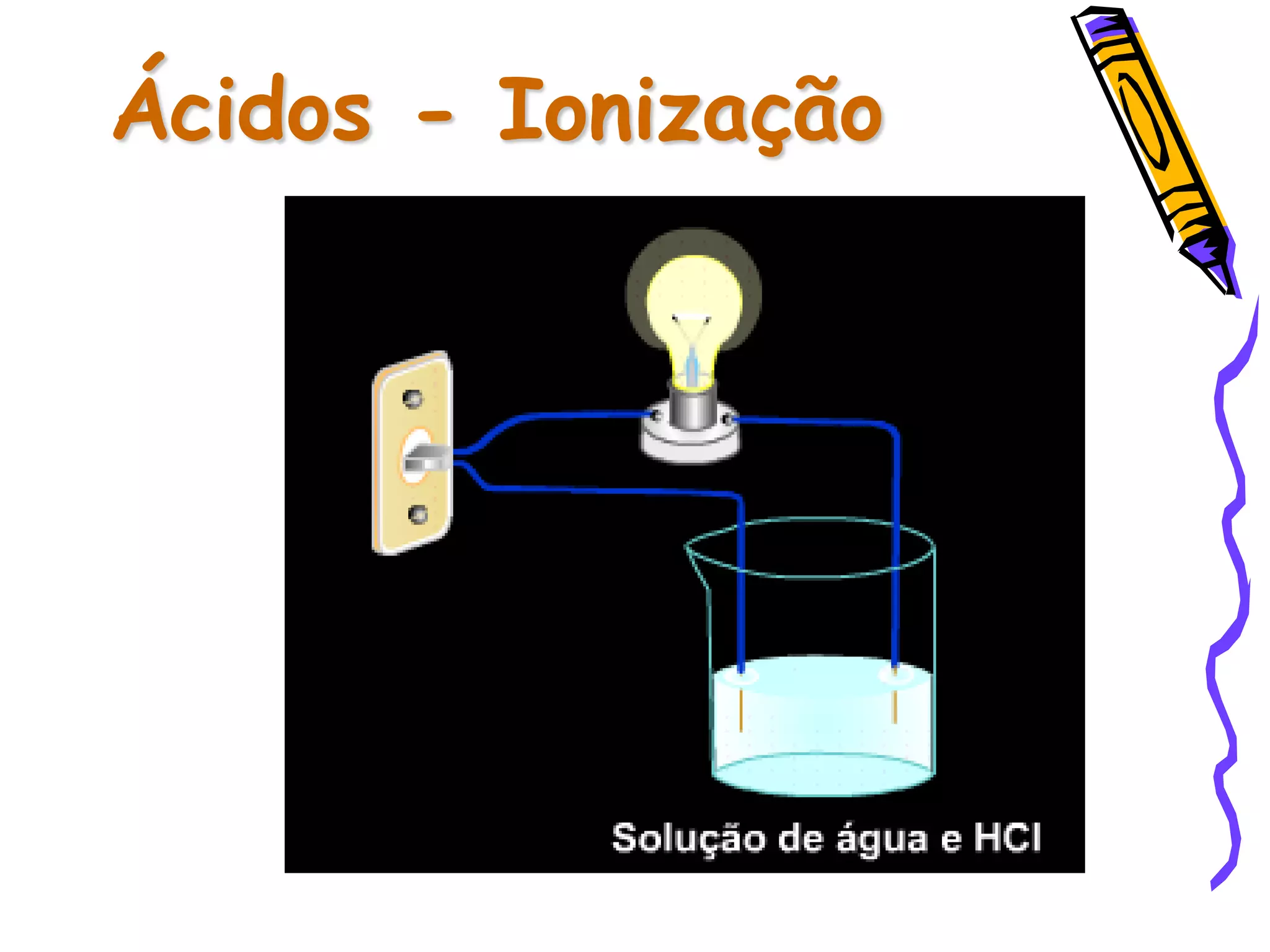
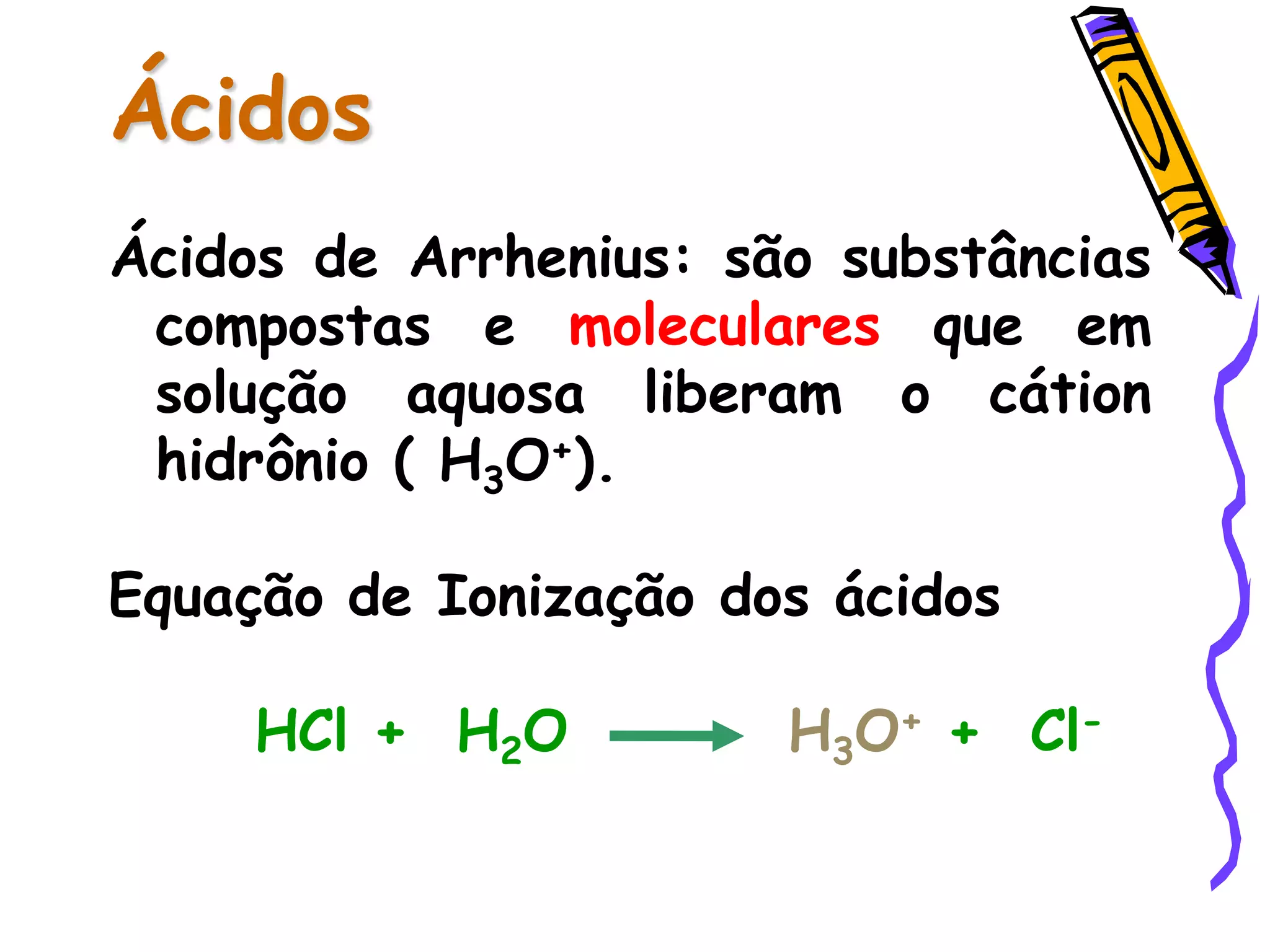
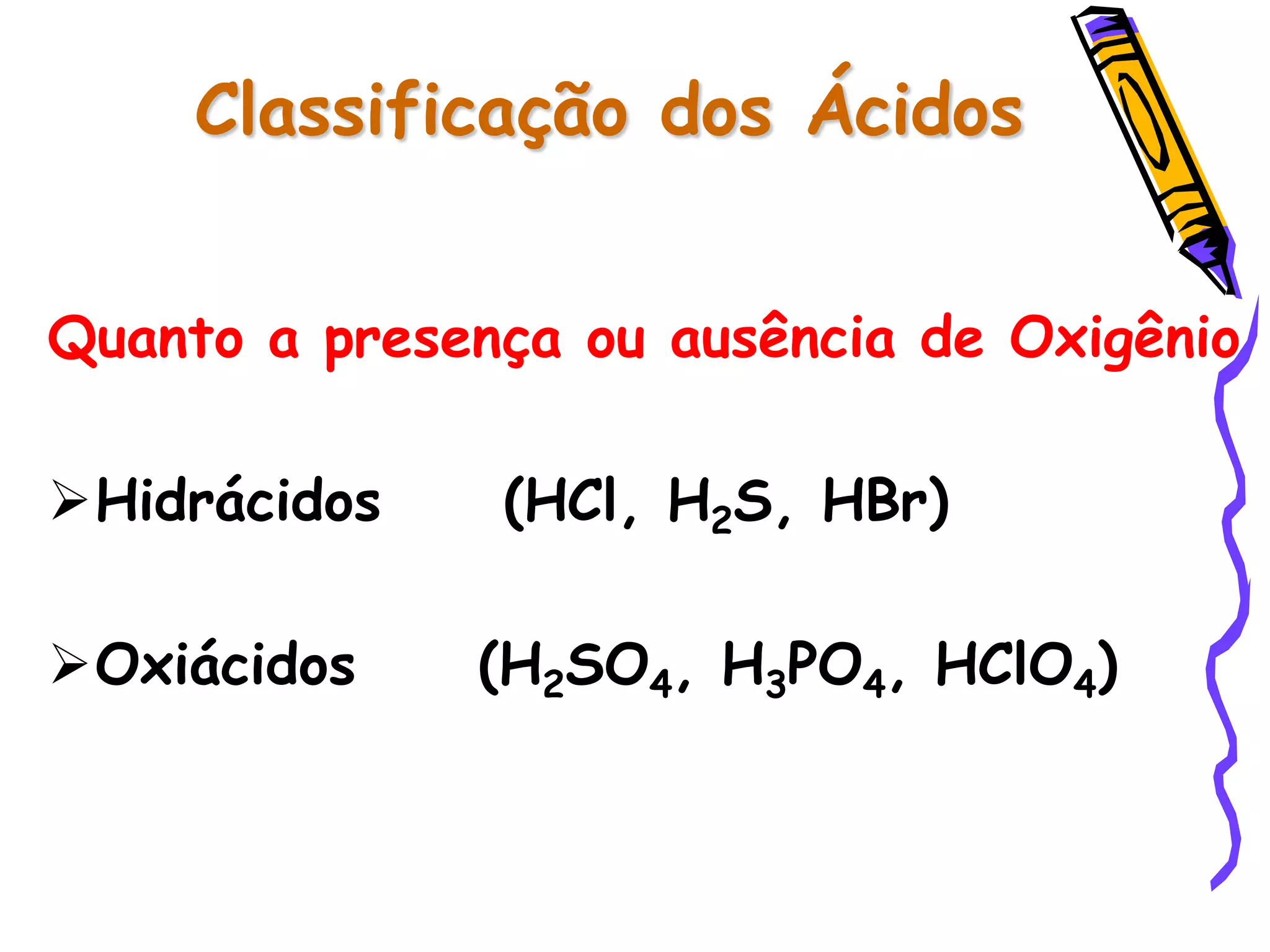
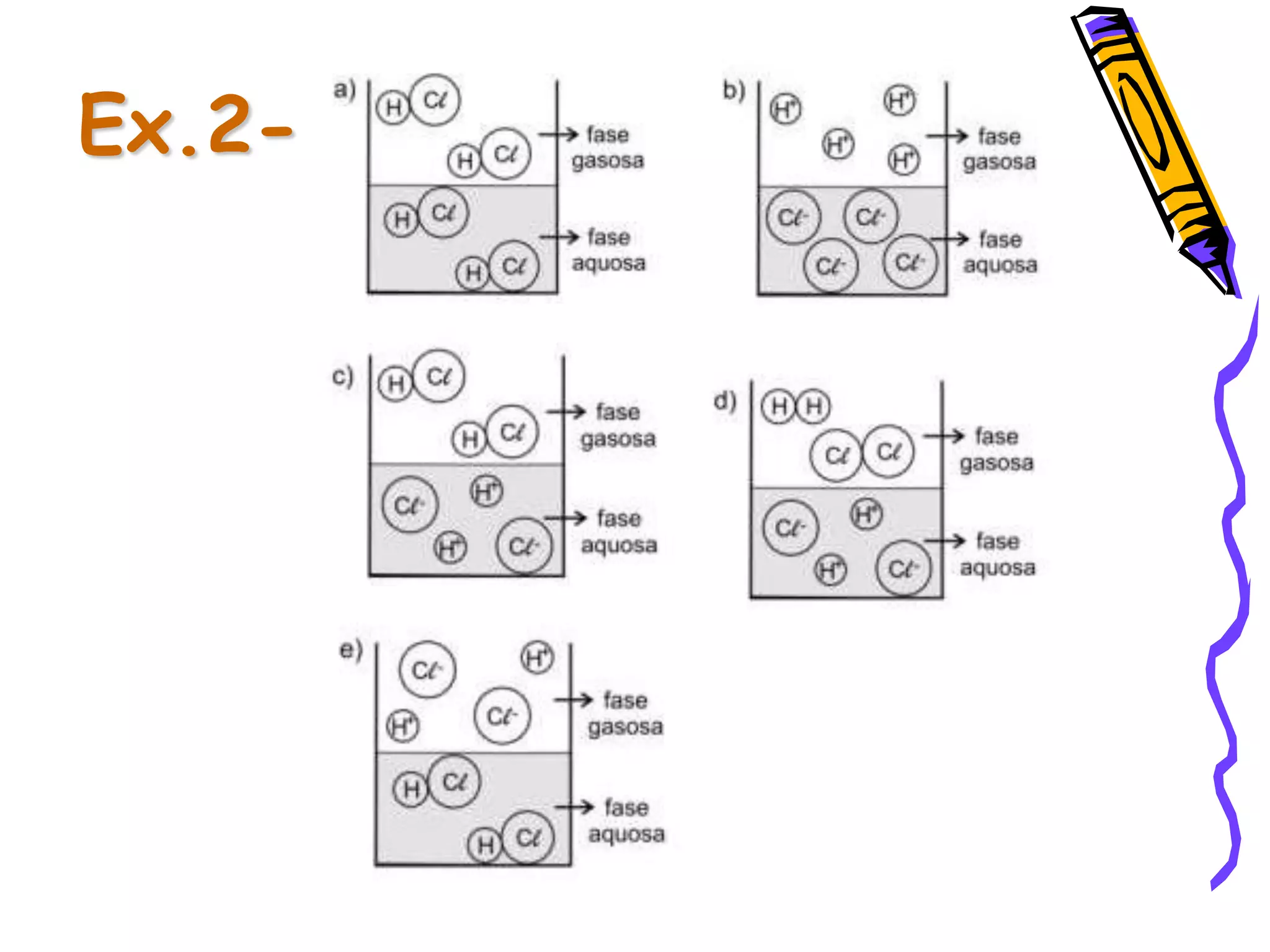
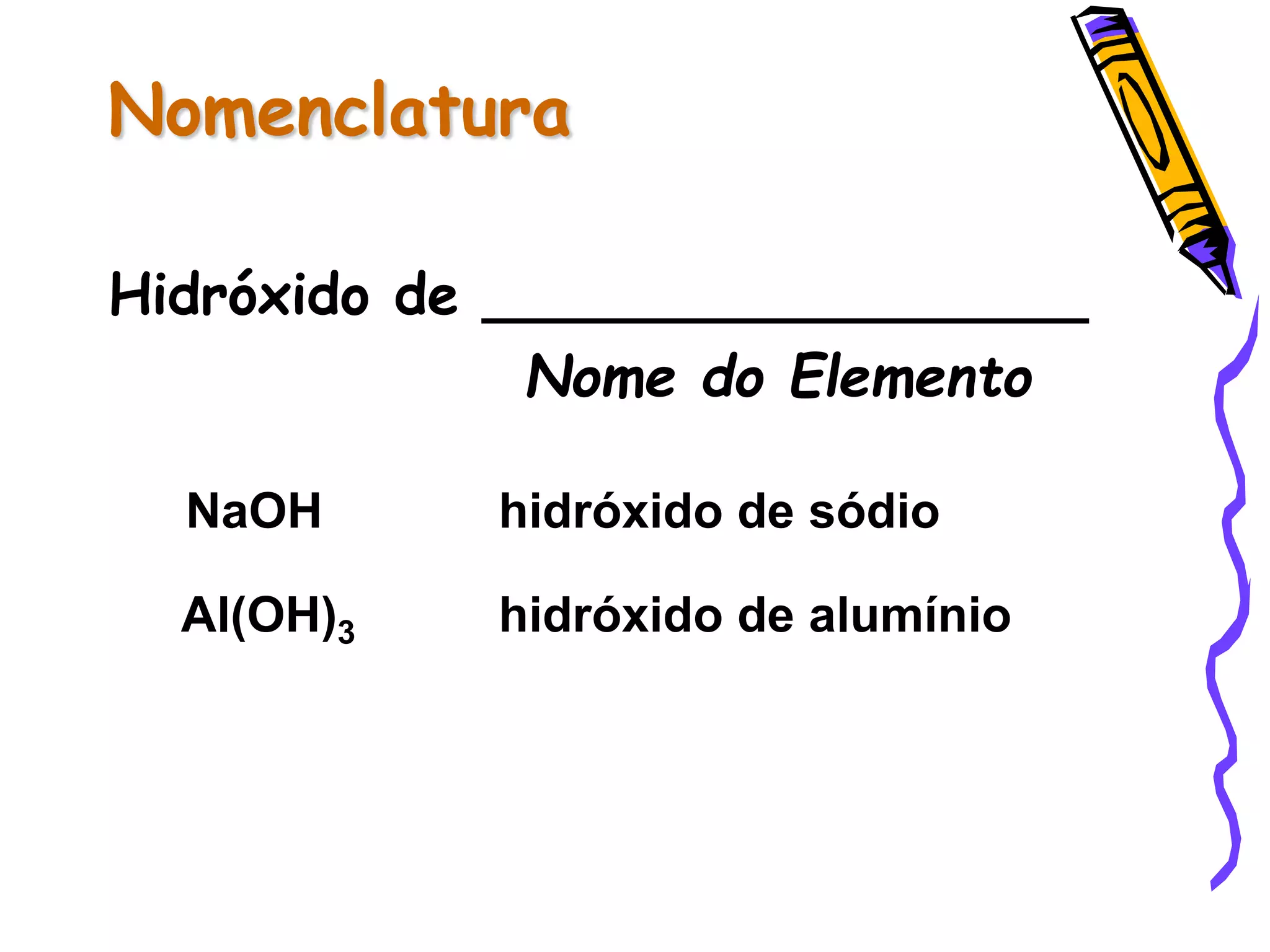
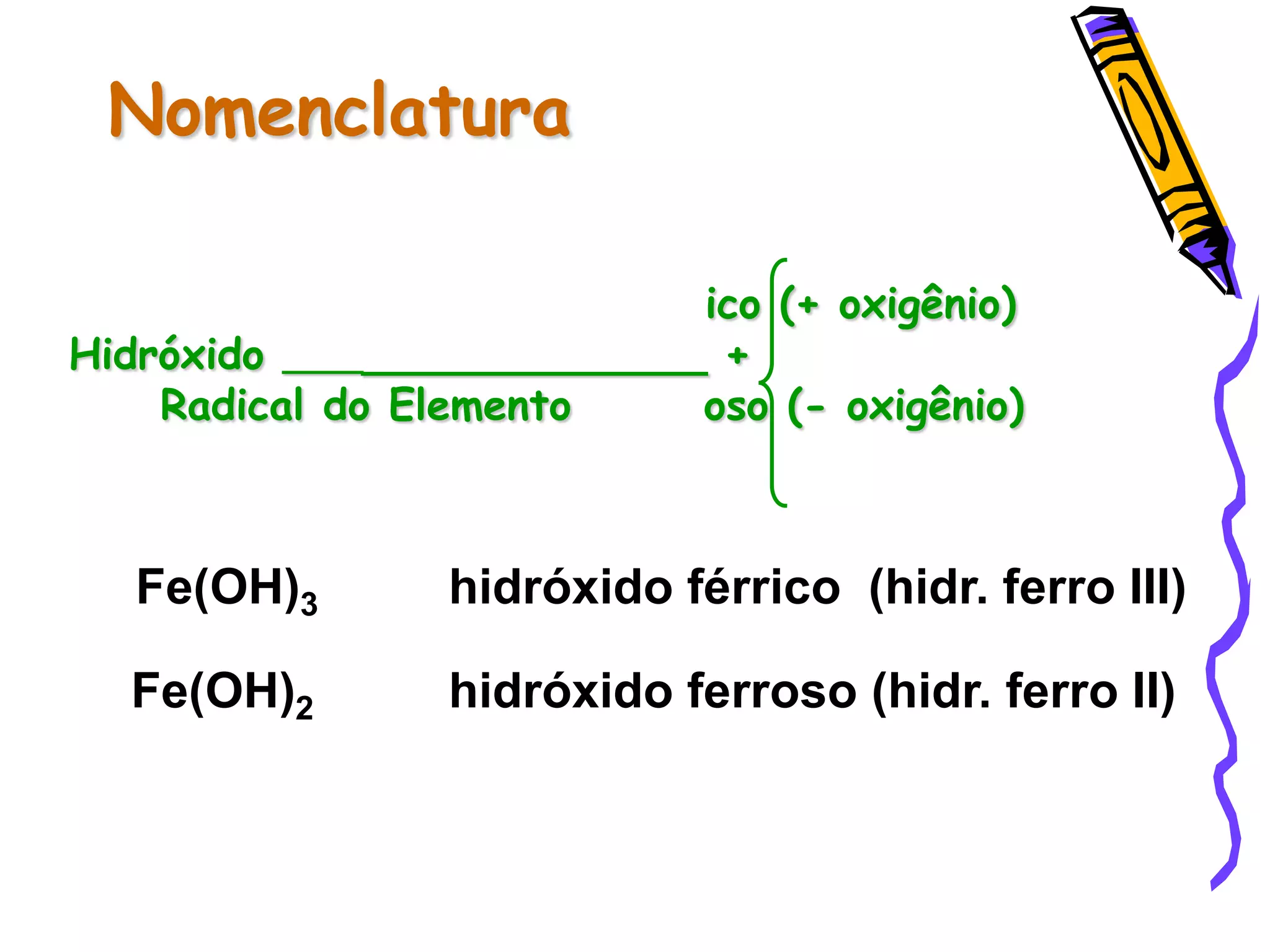
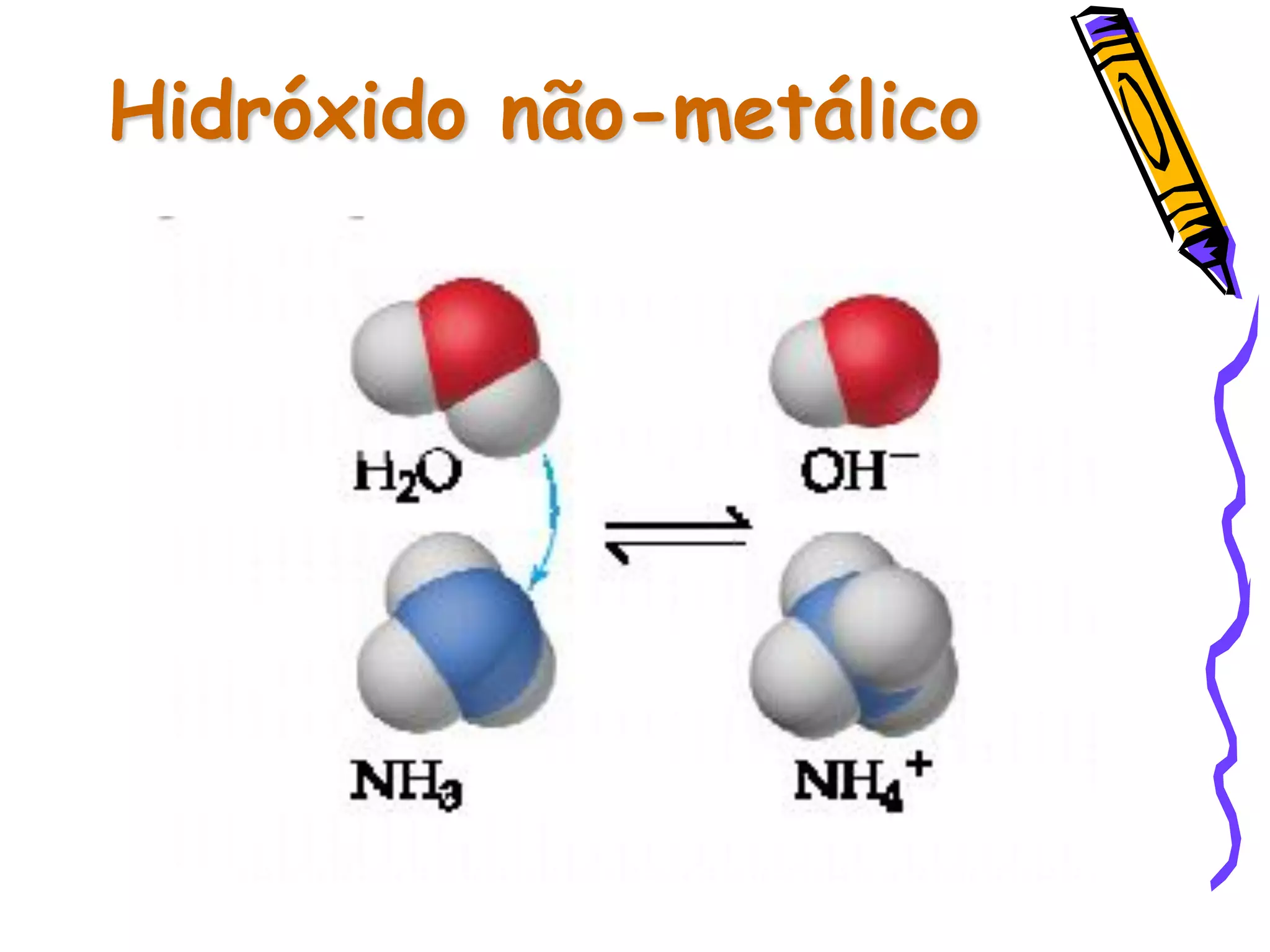
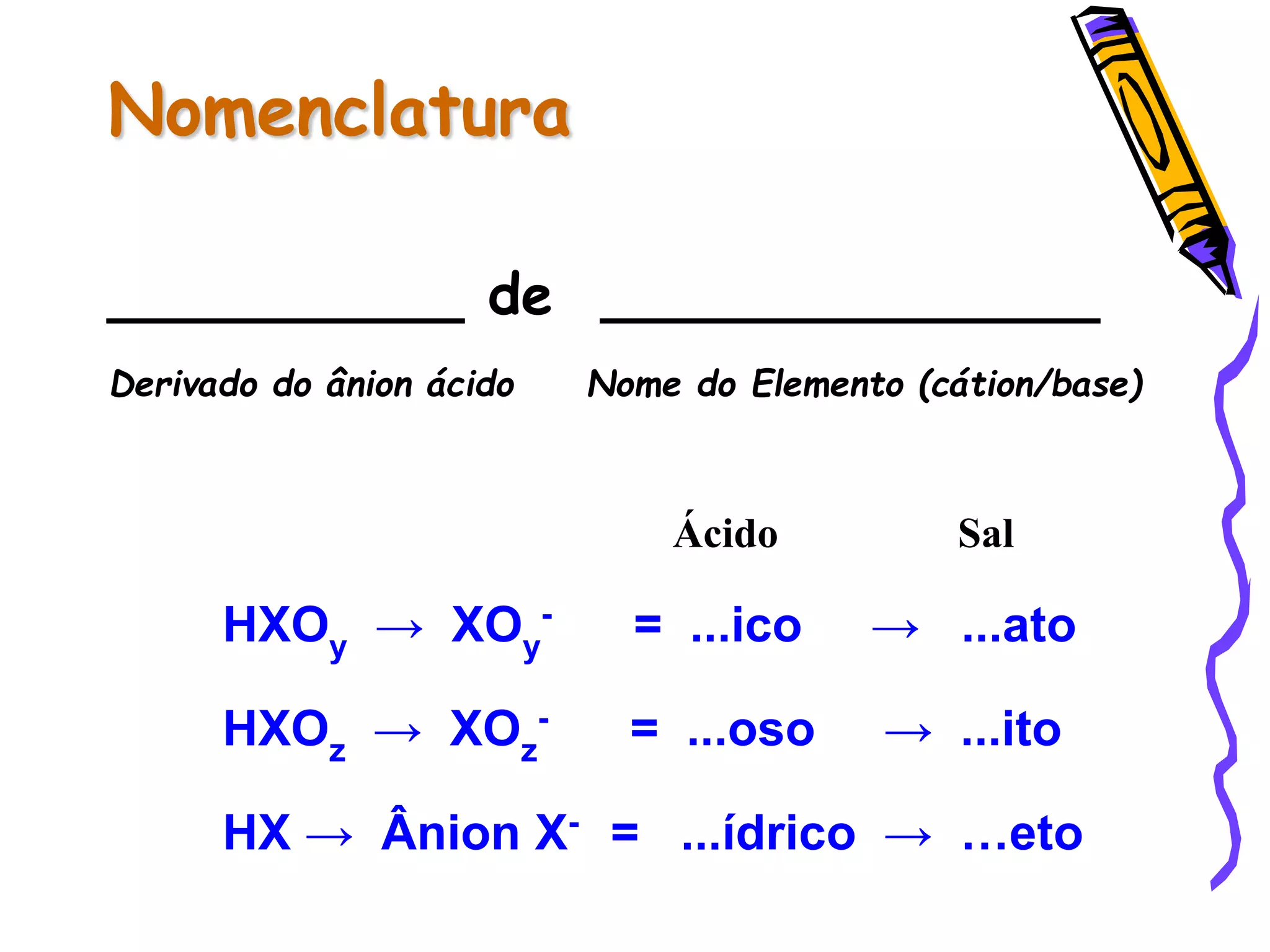
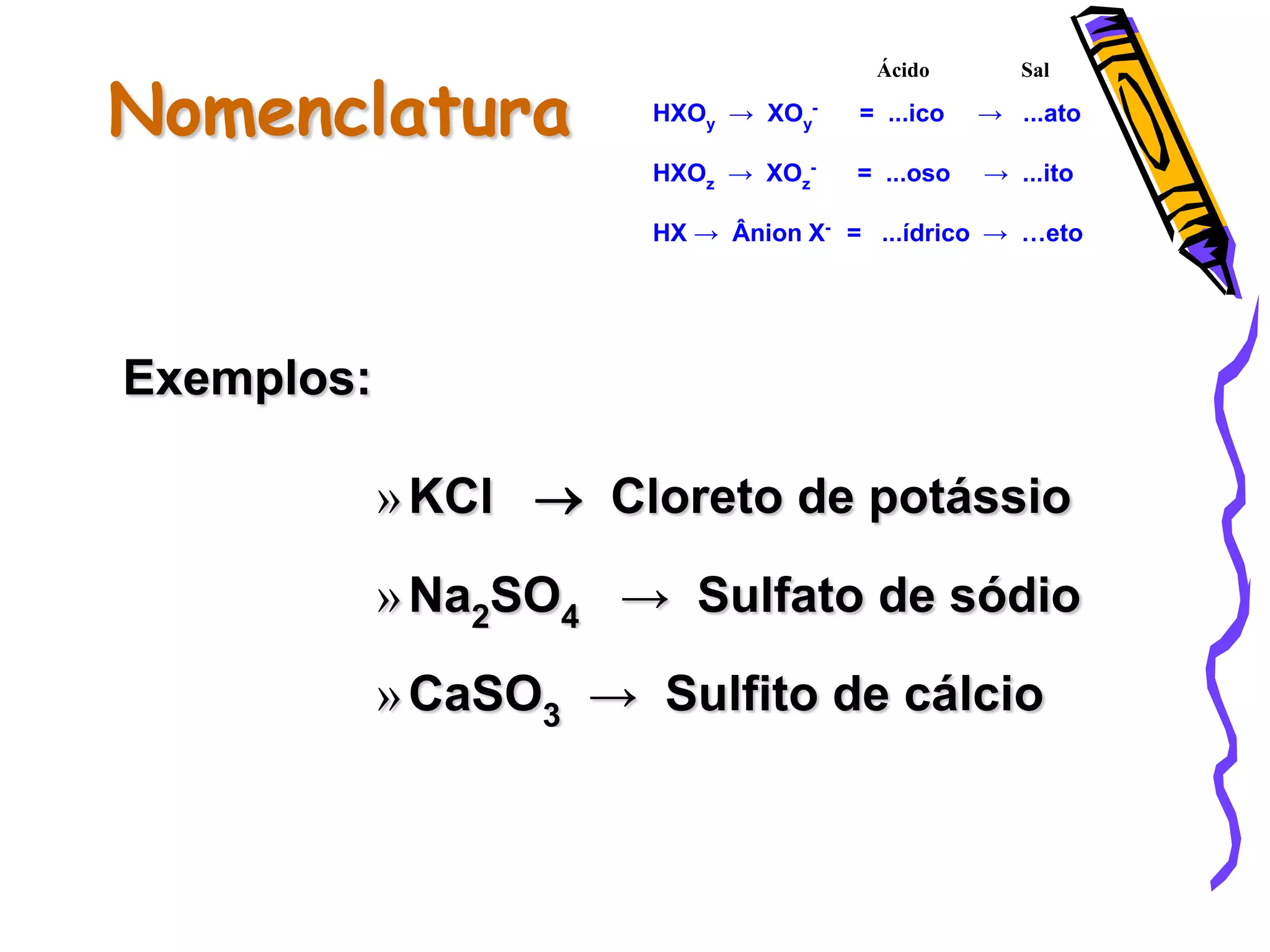
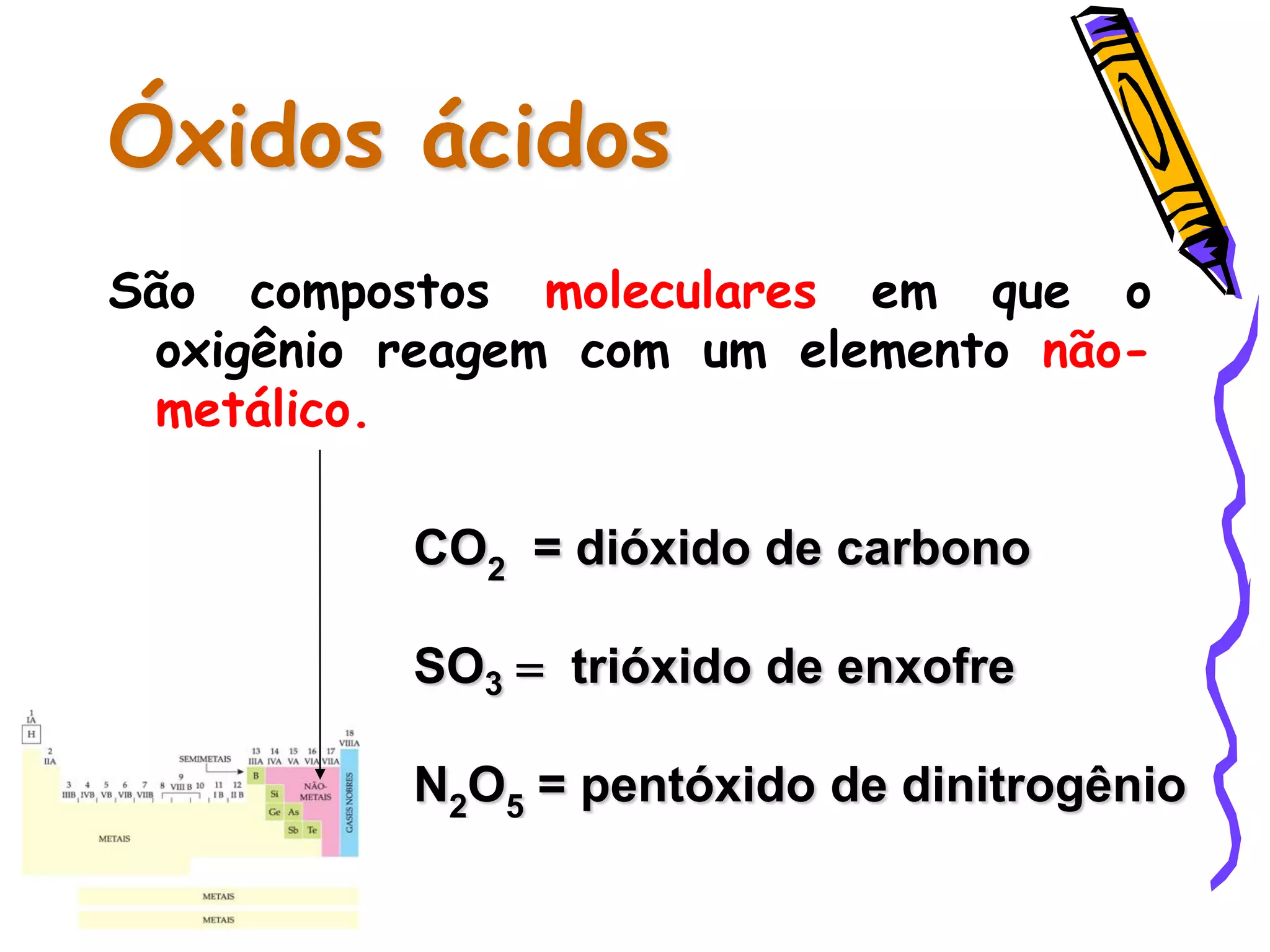
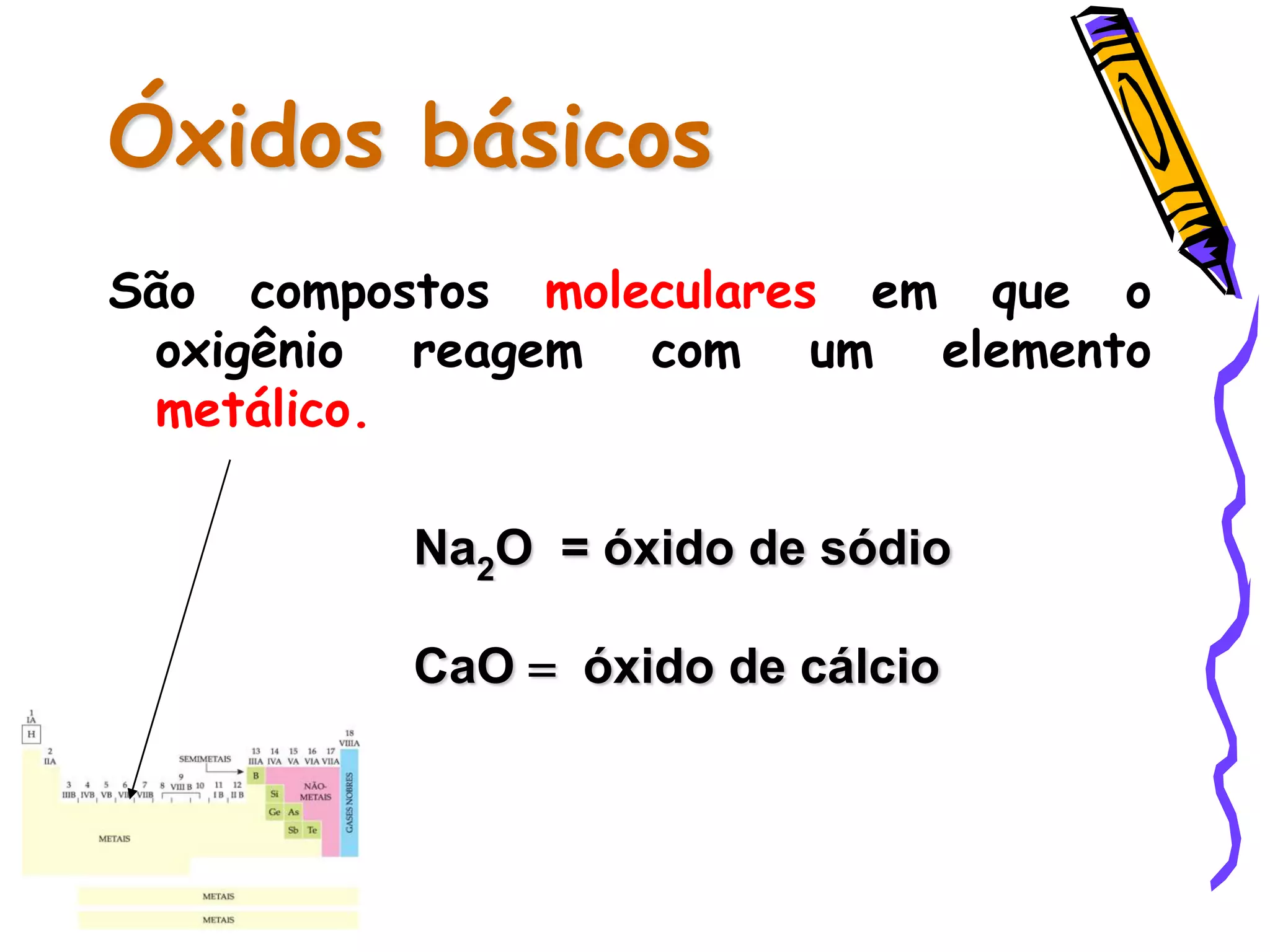
Este documento resume conceitos sobre ácidos, bases, sais e óxidos inorgânicos. Ele define ácidos e bases segundo Arrhenius e explica suas propriedades. Também discute a nomenclatura, classificação e reações de neutralização para formar sais. Por fim, aborda os tipos de óxidos, incluindo óxidos ácidos, básicos e neutros.