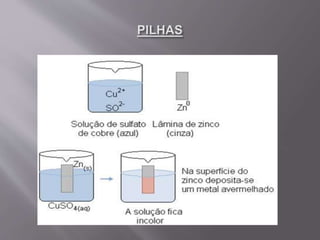
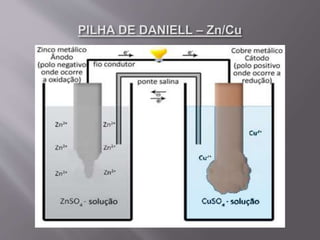
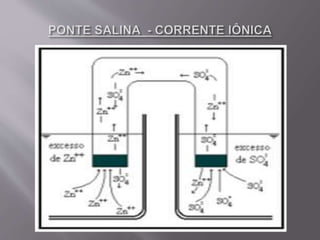
1) A eletroquímica estuda as reações de oxirredução e o uso de corrente elétrica para produzi-las. 2) Pode ser dividida em pilhas/baterias, que geram corrente elétrica, e eletrólise, onde a corrente produz reações. 3) A pilha de Daniell usa zinco e cobre em soluções separadas para gerar corrente, com a ponte salina equilibrando as cargas das soluções.