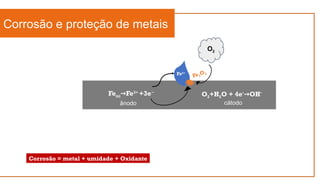
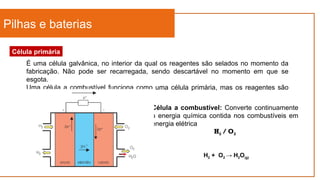
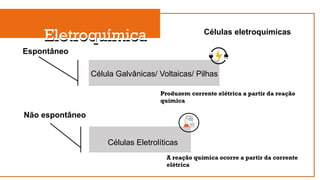
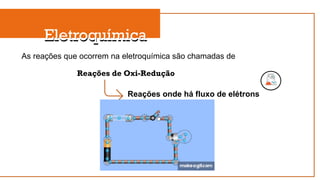
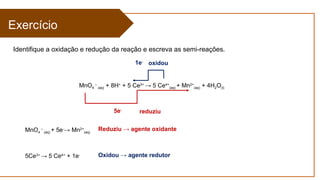
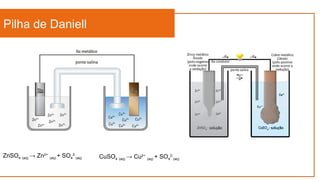
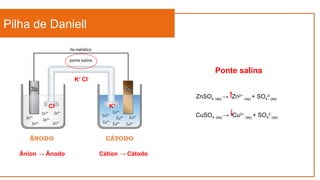
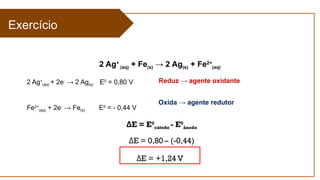
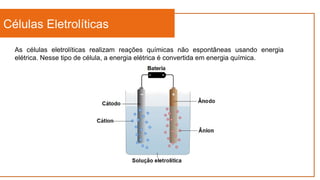
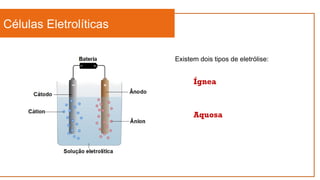
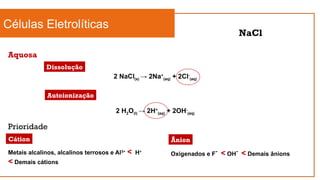
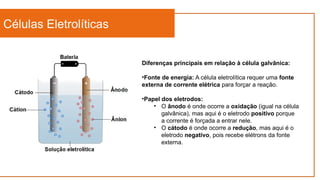
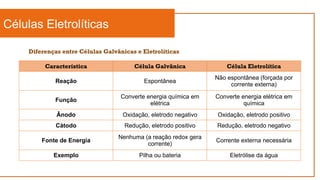
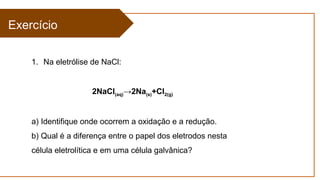
O documento aborda a eletroquímica, que estuda a relação entre reações químicas e eletricidade, focando na produção de hidrogênio e células combustíveis. Explica conceitos como reações de oxi-redução, número de oxidação, e diferenciação entre células galvânicas e eletrolíticas, além de apresentar experimentos históricos relevantes de Galvani e Volta. Por fim, destaca a importância da eletroquímica em tecnologias diversas, incluindo baterias e eletrodeposição.































![Equação de Nernst
Qual é o potencial da célula E em 25°C para a célula com as condições descritas
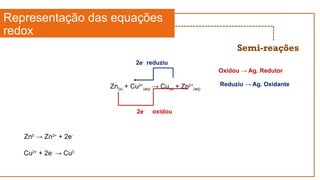
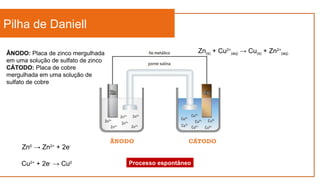
Zn(s) + Cu2+
(aq) → Cu(s) + Zn2+
(aq)
Cu2+
+ 2e-
→ Cu0
E0
= + 0,34 V
Zn2+
+ 2e-
→ Zn0
E0
= - 0,76 V
[Zn2+
] =0,01M;](https://image.slidesharecdn.com/revisoeletroquimica-250131164713-649e1263/85/Revisao-eletroquimica-estudar-e-aprender-de-forma-simples-50-320.jpg)