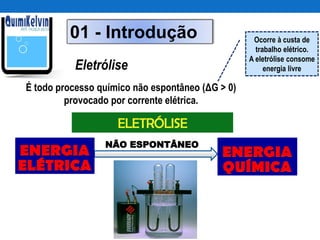
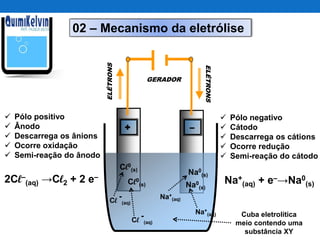
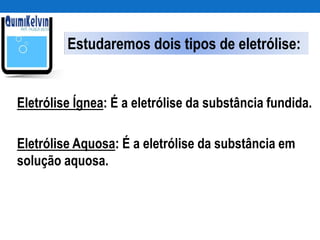
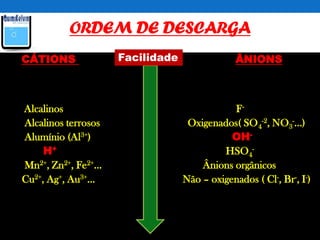
O documento discute o processo de eletrolise, incluindo sua definição, aplicações, mecanismos e aspectos quantitativos. A eletrolise é um processo químico não espontâneo induzido por corrente elétrica que pode ser usado para produzir metais como alumínio e ferro galvanizado ou gases como cloro e hidrogênio. A lei de Faraday relaciona a massa de substância produzida ou consumida durante a eletrolise com a quantidade de carga elétrica que atravessa o eletrólito.