Incorporar apresentação
Baixado 12 vezes


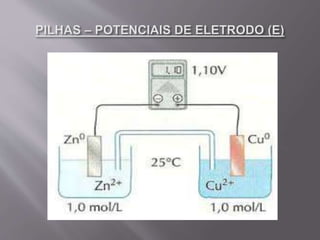






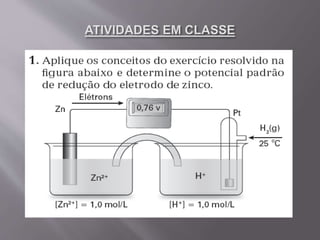








O documento explica que o potencial de um eletrodo indica sua tendência a sofrer oxidação ou redução. O potencial-padrão é medido em volts e calculado pela diferença entre os potenciais dos eletrodos de um sistema, sendo o eletrodo com maior potencial de redução o cátodo.
















