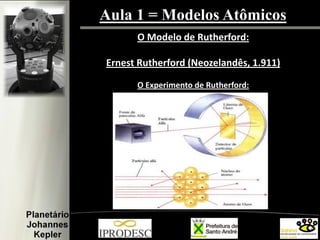
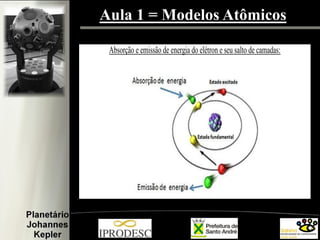
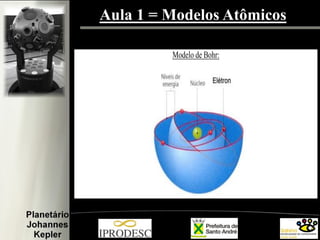
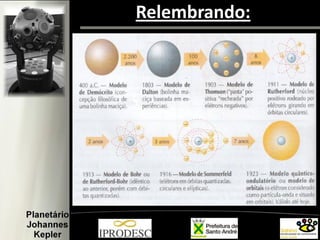
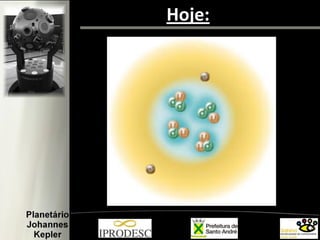
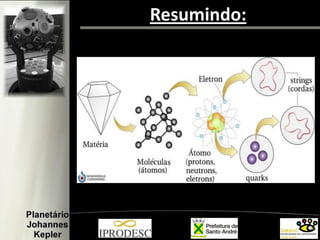
O documento aborda a formação e estrutura dos átomos, desde as teorias de Demócrito até os modelos atômicos modernos, incluindo os de Dalton, Thomson, Rutherford e Bohr. Também menciona a descoberta do nêutron e introduz a teoria dos quarks como as menores partículas conhecidas, além de citar a teoria das cordas. Finalmente, agradece a equipe do planetário e o conteúdo é voltado para capacitação de professores em astronomia no ensino fundamental.