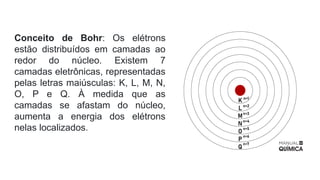
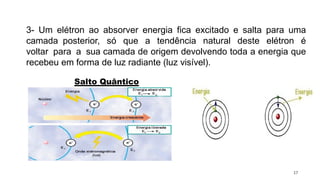
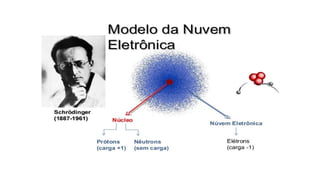
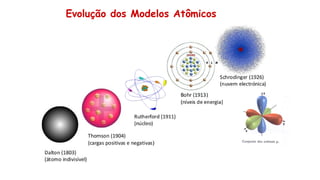
O documento aborda a evolução dos modelos atômicos desde as ideias filosóficas de Leucipo e Demócrito até os conceitos modernos de Schrödinger, ressaltando a natureza do átomo como a menor unidade de matéria e sua estrutura interna composta por prótons, nêutrons e elétrons. Através de diferentes modelos, como o de Dalton, Thomson, Rutherford e Bohr, são discutidos aspectos como a indivisibilidade dos átomos, a estrutura do núcleo e a distribuição dos elétrons. O texto também enfatiza a importância das contribuições científicas para a compreensão atual da estrutura atômica.











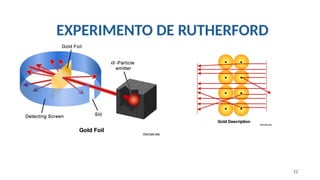












![5- Em sua experiência, que levou ao modelo do átomo
nucleado, Rutherford bombardeou [1] com [2]. As
lacunas [1] e [2] são corretamente preenchidas,
respectivamente, com:
a) uma lâmina delgada de ouro e raios catódicos.
b) uma barra de ouro e partículas α (alfa).
c) uma lâmina delgada de ouro e nêutrons;
d) uma lâmina delgada de ouro e partículas α (alfa);](https://image.slidesharecdn.com/aula03modelosatmicos-240816163842-eeeb2f5a/85/Modelos-Atomicos_de-Dalton-a-Schrodinger-29-320.jpg)


