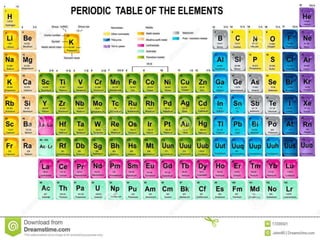
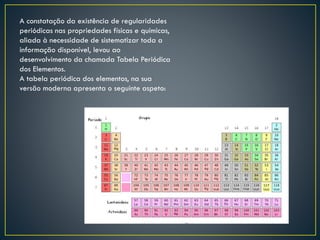
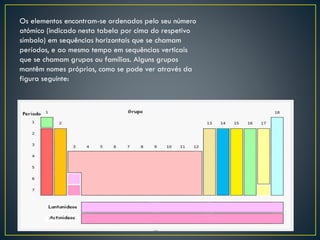
Dmitri Mendeleiev ordenou os elementos químicos conhecidos em uma tabela periódica que mostrava padrões nas propriedades dos elementos. Sua tabela previu novos elementos e serviu de base para a tabela periódica moderna, que organiza 118 elementos de acordo com suas propriedades.