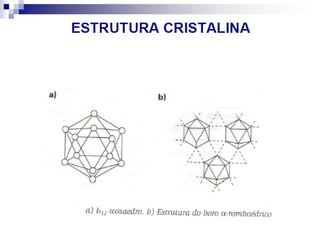
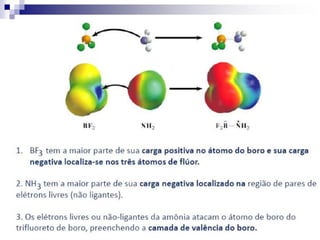
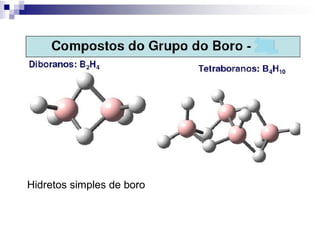
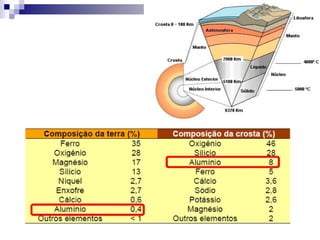
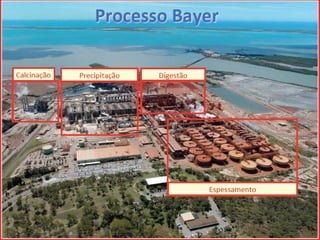
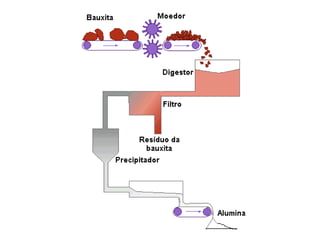
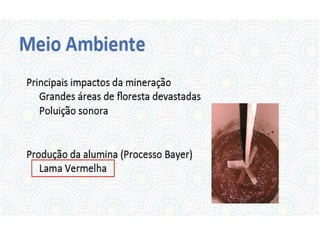
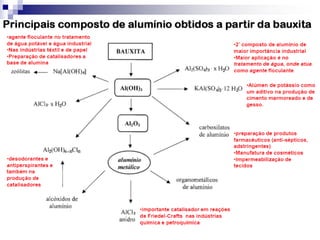
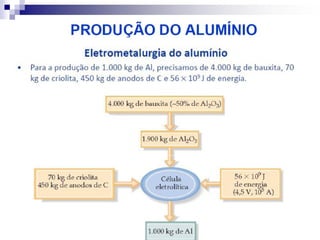
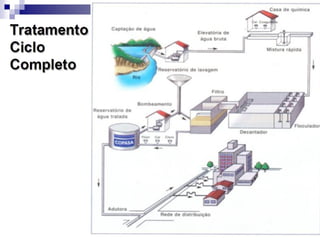
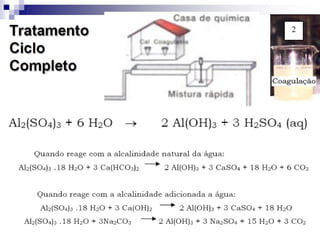
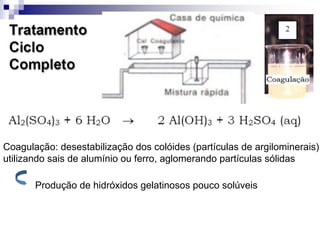
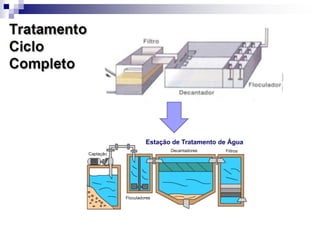
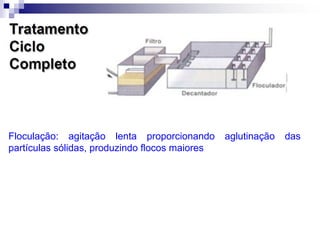
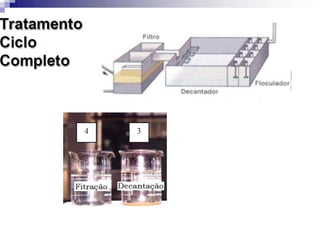
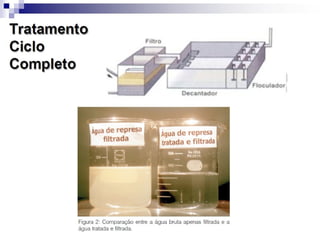
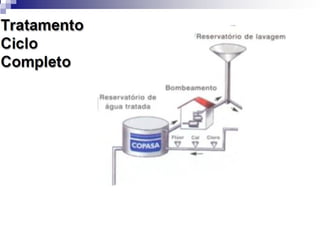
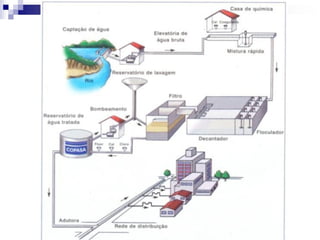
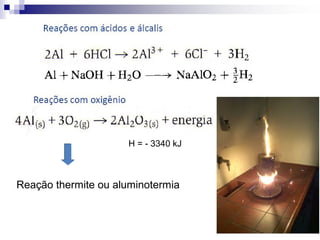
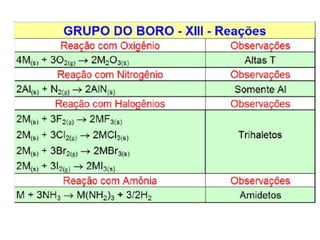
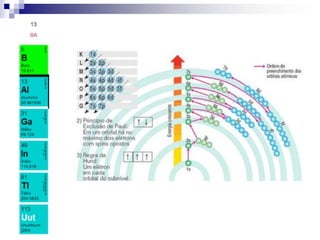
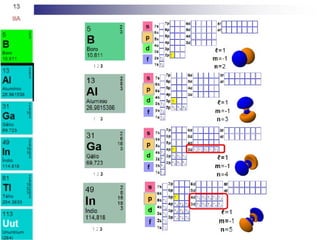
O documento descreve as propriedades químicas dos elementos do Grupo 3A (Boro, Alumínio, Gálio, Índio e Tálio). Apresenta suas estruturas eletrônicas, estados de oxidação, propriedades físicas e químicas, compostos formados, usos e métodos de produção industrial, com foco no Alumínio.





![O Estado de Oxidação (+1 e +3)
O efeito do par inerte acontece também em outros elementos
mais pesados de outros grupos do bloco p
Sn e Pb (Grupo 4) e Sb e Bi (Grupo 5)
O Gálio é aparentemente bivalente em alguns compostos.
GaCl2
Estrutura do GaCl2 é Ga+[GaCl4]-, que contém gálio nos dois
estados de oxidação: +3 e +1](https://image.slidesharecdn.com/aula05-grupo3aeng-131216145044-phpapp01/85/Aula-05-grupo-3A-10-320.jpg)