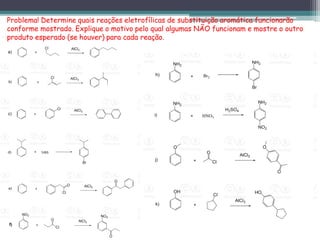
1) O documento discute várias reações de substituição aromática eletrofílica e nucleofílica.
2) As reações de substituição eletrofílica incluem alquilação, acilação, nitração e halogenação de Friedel-Crafts.
3) As reações de substituição nucleofílica envolvem a conversão de sais de diazônio aromáticos em haletos, fenóis e outros derivados.

















































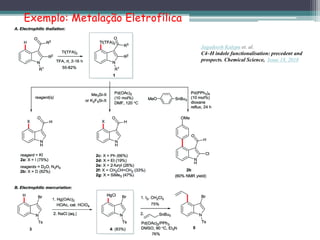























![Exemplo: Ciclo-adição!
[4+2] Cycloaddition in the synthesis of defucogilvocarcin M (Hosoya and Sumida,
2014): Org. Lett., 2014, 16 , 6240 —6243](https://image.slidesharecdn.com/compostosaromticos-profsidney-ufpi-210705011811/85/Compostos-aromaticos-prof-sidney-ufpi-76-320.jpg)





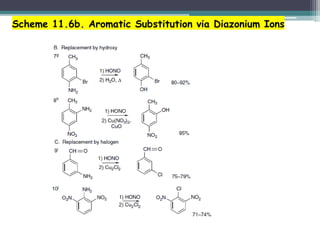
![• A reação de clorobenzeno com N-metil Anilina e Pd[P(t-Br)3]2 e bases
diferentes, indicam dois mecanismos diferentes: o ciclo da direita com
adição oxidativa seguida de desprotonação da amina e no ciclo da
esquerda a adição oxidativa ocorre no aduto aniônico do catalisador e da
base, seguido por subst. pela amina.
adição oxidativa seguida de
desprotonação da amina
adição oxidativa ocorre no aduto
aniônico do catalisador e da base
82
✓Nestas reações cloretos são mais reativos que brometos e iodetos;](https://image.slidesharecdn.com/compostosaromticos-profsidney-ufpi-210705011811/85/Compostos-aromaticos-prof-sidney-ufpi-82-320.jpg)








