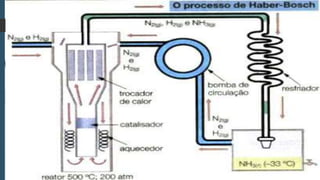
O documento descreve as propriedades, usos e obtenção da amônia. A amônia é um gás incolor e solúvel em água que é usado na fabricação de fertilizantes e como refrigerante industrial. Sua produção em larga escala é feita pelo processo de Haber-Bosch, desenvolvido por Fritz Haber e Carl Bosch, que envolve reação de nitrogênio e hidrogênio a altas temperaturas e pressões na presença de um catalisador.















![A amônia forma ions complexos
4 NH3(aq) + Cu2+(aq) [Cu(NH3)4]2+
NH3
..
H3N : : NH3 Cu
..
NH3
2+
Ligações coordenadas
ou covalentes dativas
Cation tetraaminocobre(II)
Complexo
Cu(OH)2(s)
Cu2+(aq)](https://image.slidesharecdn.com/amnia-141125101010-conversion-gate01/85/Amonia-17-320.jpg)
![Por que se forma hidróxido de cobre(II)?
Como o NH3 é uma base, reage com a água
e produz ions OH¯que precipitam o Cu(II):
2 HO¯(aq) + Cu2+(aq) Cu(OH)2(s)
Com excesso de NH3, o precipitado
dissolve-se e forma-se o complexo, solúvel:
Cu(OH)2(s) + 4 NH3(aq) [Cu(NH3)4]2+ + 2 OH¯(aq)](https://image.slidesharecdn.com/amnia-141125101010-conversion-gate01/85/Amonia-18-320.jpg)



