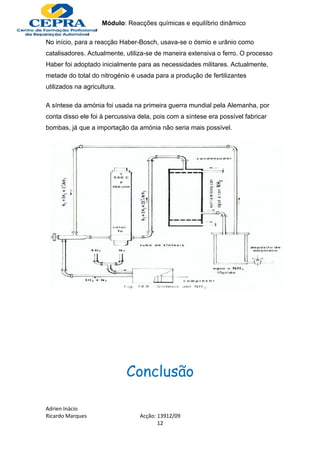
Este documento discute vários aspectos do amoníaco, incluindo sua história, importância, síntese e o processo Haber-Bosch para produzi-lo industrialmente através da reação de nitrogênio e hidrogênio sob alta pressão e temperatura moderada usando um catalisador de ferro.