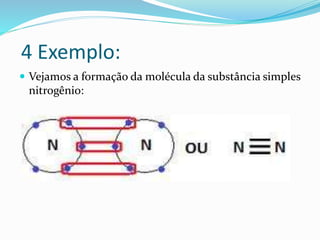
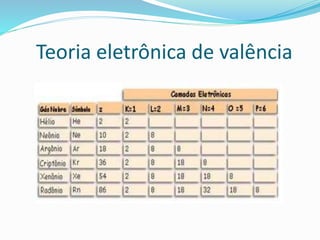
O documento discute diferentes tipos de ligação covalente, incluindo exemplos de formação de moléculas de hidrogênio, cloro, oxigênio e nitrogênio. Explica que a ligação covalente envolve a partilha de elétrons entre átomos, e que alguns átomos podem formar ligações duplas ou dativas em que um átomo cede elétrons ao outro.



![Exemplo:
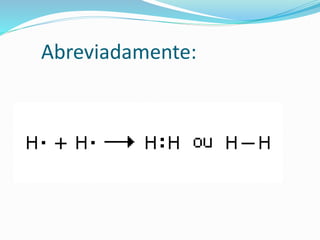
Consideremos a união entre dois átomos do elemento
hidrogênio,para formar a molécula da substâncias
simples hidrogênio [ H2].
H + H ----› H2](https://image.slidesharecdn.com/ligacaocovalente22-141201171750-conversion-gate01/85/Ligacao-covalente-22-4-320.jpg)
![2 Exemplo:
Consideremos a união entre dois átomos do elemento
cloro [Cl] formando uma molécula da substância
simples [Cl2],como segue abaixo:](https://image.slidesharecdn.com/ligacaocovalente22-141201171750-conversion-gate01/85/Ligacao-covalente-22-6-320.jpg)



![Caso particular
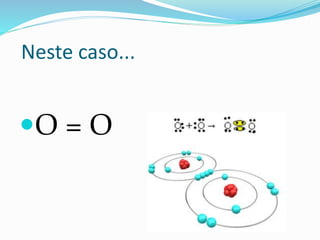
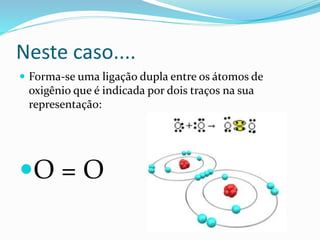
Vejamos o exemplo da formação da molécula de gás
sulfuroso [SO2]
Trata-se não mais de uma ligação covalente usual,em
que cada ligação é formada por 1 elétron de cada
átomo,mas de uma covalência especial,na qual o par
eletrônico é cedido apenas por uma seta que vai do
átomo doador para o átomo receptor do par eletrônico.](https://image.slidesharecdn.com/ligacaocovalente22-141201171750-conversion-gate01/85/Ligacao-covalente-22-14-320.jpg)
