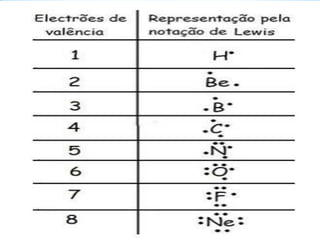
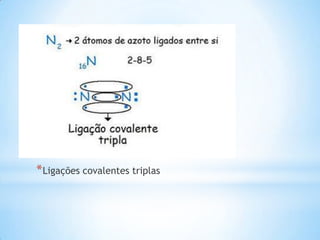
Gilbert Newton Lewis foi um físico e químico norte-americano que propôs em 1916 a notação de Lewis para representar a estrutura eletrônica dos átomos. Esta notação representa os eletrões de valência dos átomos e permite prever a formação de ligações químicas entre eles, indicando se as ligações são simples, duplas ou triplas.