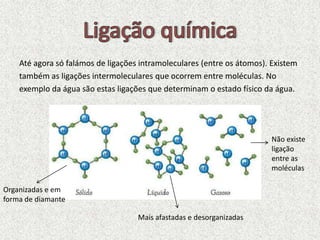
O documento explica como os átomos se ligam através de ligações químicas para formar moléculas. Descreve dois tipos principais de ligações: ligações covalentes, onde átomos compartilham elétrons, e ligações iônicas, onde átomos transferem elétrons. Também discute como os metais se ligam através de uma "mar de elétrons".