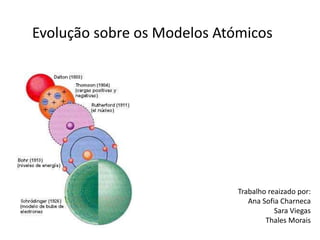
Evolução sobre os modelos atómicos
- 1. Evolução sobre os Modelos Atómicos Trabalho reaizado por: Ana Sofia Charneca Sara Viegas Thales Morais
- 2. Já no início do séc. XIX John Daton (1766-1844) “Os átomos são indivisíveis.” Átomo: (1807) Partícula esférica, maciça, neutra e indivisível
- 3. Nos finais do séc XIX... Em 1897, descobriu o electão, partícula com carga elétrica negativa e muito menor do que o átomo.
- 4. Em 1904 Thomson propôs um novo modeo atómico.... Esfere com carga eléctrica positiva Electrões (partículas com carga eléctrica negativa)
- 5. Thomson Modelo do “pudim de passas” Átomo: Esfera de carga eléctrica positiva, na qual os electrões de carga eléctrica negativa, se encontravam dispersos, em números suficiente para tornar o átomo neutro.
- 6. No início do séc. XX... Rutherford (1871-1937) Em 1908 reaizou uma experiência que lhe permitiu propor um novo modelo atómico
- 8. Experiência de Rutherford Resutados previstos segundos o modelo de Thomson: A partículas a deveriam atravessar as folhas de outro sem sofrer desvios. A maior parte das partículas a comportava-se com esperado, mas um significativo número deas desviam-se muito, podendo mesmo voltar para trás. Resutados obtidos:
- 9. Resultados da experiência de Rutherford Rutherford concuiu que existe, no interior do átomo, uma região central positiva – o núcleo, que exerce fortes forças repulsivas sobre as partículas alfa.
- 10. Modelo proposto por Rutherford (1911): O átomo é uma estrutura praticamente vazia, e não uma esfera maciça; É constituído por: O átomo seria um sistema semelhante ao sistema solar. Núcleo muito pequeno com carga positiva, onde se concetra quase toda a massa do átomo. Electrões com carga negativa movendo-se em volta do núcleo. Modelo Planetário
- 11. Em 1932.... Chadwik descobriu outro tipo de partículas existente no núceo do átomo: o neutrão Os neutrões são partículas sem carga elétrica. James Chadwick (1891-1974)
- 12. Em 1913... Os electrões movem-se em torno do núcleo, me órbitas circuares bem definidas Camadas ou níveis
- 13. Modelo da Nuvem Electrónica Schrödinger (1887-1961) Núcleo Protões (carga +1) Neutrões (sem carga) Nuvem Electrónica Electrões (carga -1)
- 14. Há zonas à volta do núcleo onde é grande a probabilidade de encontrar os electrões (onde a nuvem electrónica é mais densa) e outra onde a probabilidade é menor (onde a nuvem electrónica é menos densa)
- 15. Modelo atómico de Bohr O electrão descreve uma órbita Linha onde existe a certeza de encontrar o electrão, com uma dada energia Modelo atómico Actual O electrão ocupa uma orbita Região do espaço onde há probalidade de encontrar um electrão com uma dada energia
- 16. Quais as dimensões do núcleo? Se o átomo tivesse as dimensões de um estádio, o núcleo seria do tamanho de uma joaminha colocada no centro do campo.
- 17. Resumindo O modelo atómico actual – modelo da nuvem electrónica Núcleo ( responsável pela massa do átomo) Protões que têm carga elétrica positiva; Neutrões que não têm carga elétrica; Electrões que têm carga eléctrica negativa. Nuvem eletrónica (responsável pelo tamaho do átomo).
- 18. Evolução do modelo atómico Dalton (1803) (átomo indivisível) Thomson (1904) (cargas positivas e negativas) Bohr (1913) (níveis de energia) Schrodinger (1926) (nuvem electrónica) Rutherford (1911) (núcleo)
