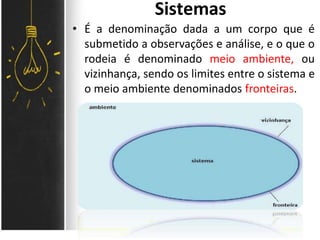
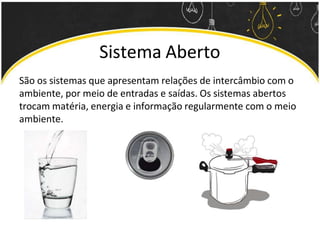
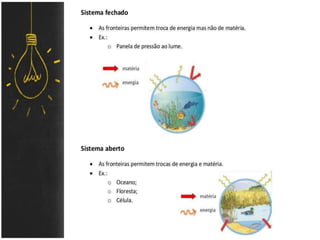
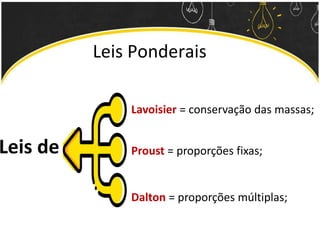
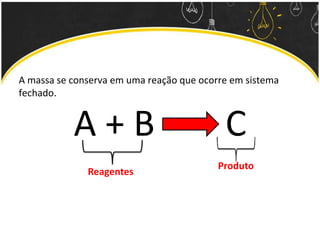
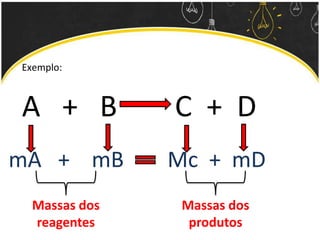
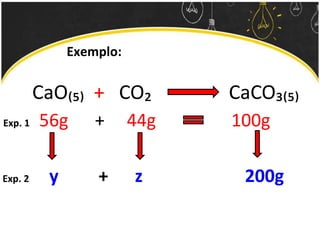
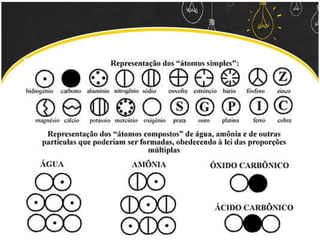
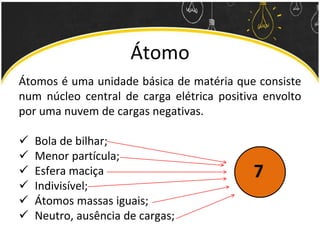
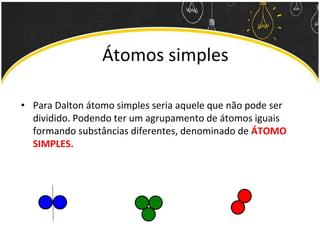
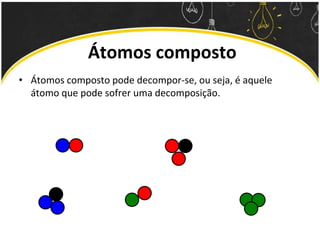
O documento discute as leis ponderais e a teoria atômica de Dalton. Apresenta as leis de conservação de massa, proporções fixas e proporções múltiplas e descreve a primeira teoria atômica proposta por Dalton, que afirmava que toda matéria é composta por átomos indivisíveis com massas iguais dentro de um mesmo elemento.