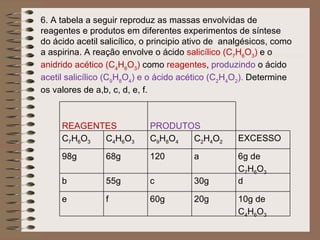
O documento descreve dois experimentos de reações químicas entre ferro e enxofre. No primeiro experimento, 56g de ferro e 40g de enxofre reagiram completamente, formando 88g de sulfeto ferroso e sobrando 8g de enxofre. No segundo experimento, 20g de ferro reagiram parcialmente com 8g de enxofre, formando 14g de sulfeto ferroso e sobrando ferro.