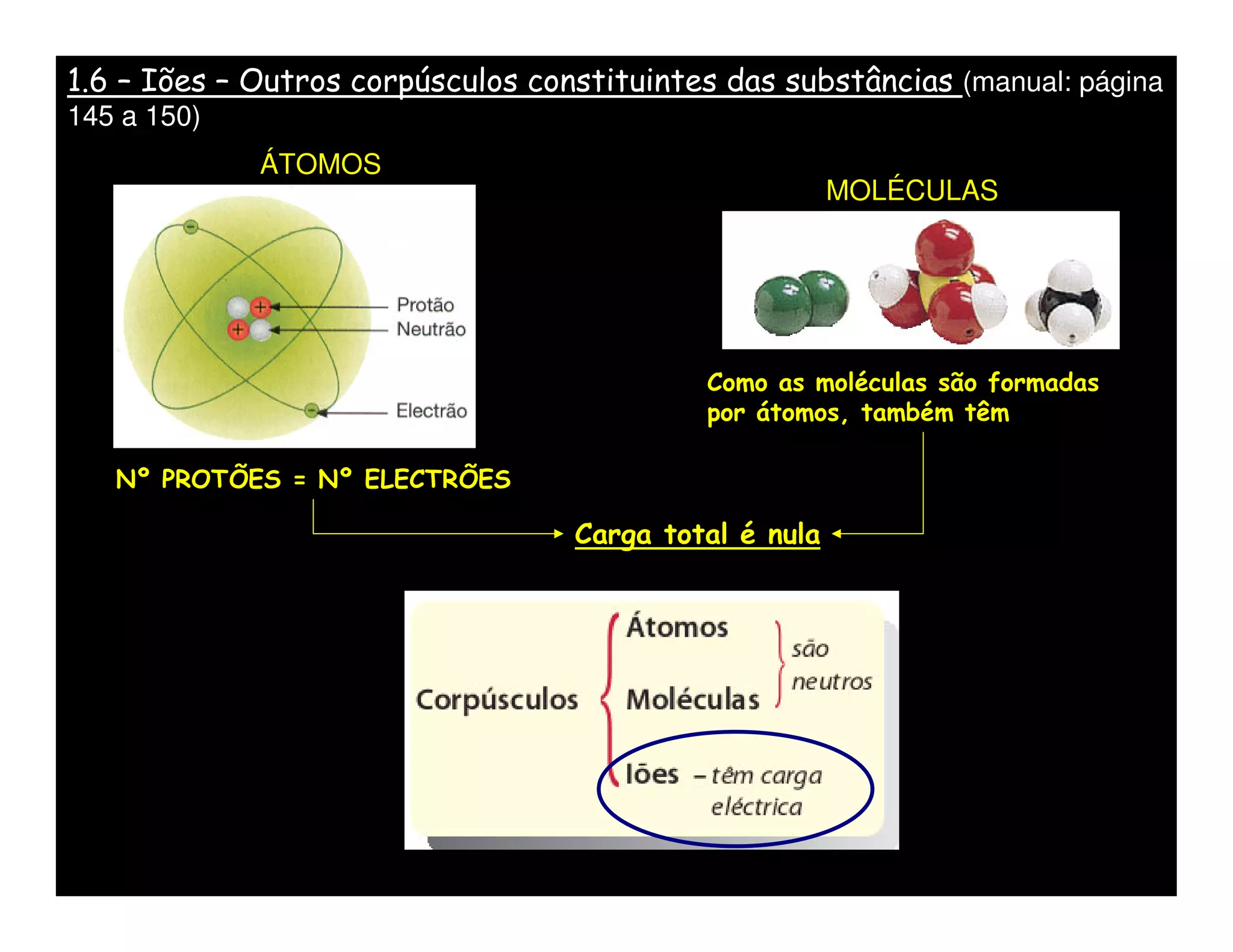
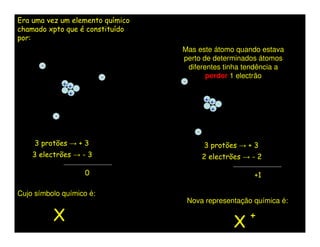
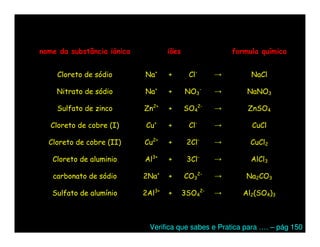
O documento descreve os conceitos de íons, cátions e ânions. Explica que um átomo ou grupo de átomos que perde elétrons torna-se positivamente carregado (cátion) e um que ganha elétrons torna-se negativamente carregado (ânion). Fornece exemplos de cátions e ânions monoatômicos e poliatômicos e explica como escrever fórmulas químicas de substâncias iônicas usando os nomes dos íons.