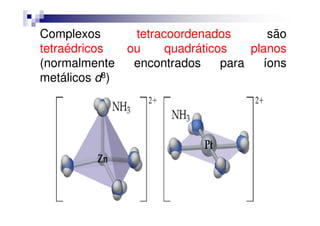
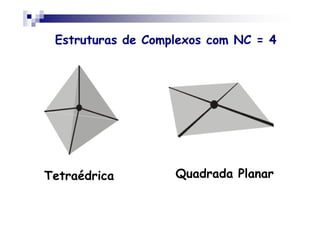
Este documento discute compostos de coordenação, que são formados por interações entre íons metálicos (ácidos de Lewis) e ligantes (bases de Lewis). Os complexos têm um íon metálico ligado a vários ligantes, e a cor do complexo depende do metal e seu estado de oxidação. A nomenclatura dos complexos descreve os ligantes e o metal.


![Os Complexos têm um íon metálico (pode
ser no estado de oxidação zero) ligado a
um número de ligantes.
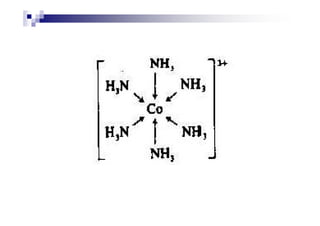
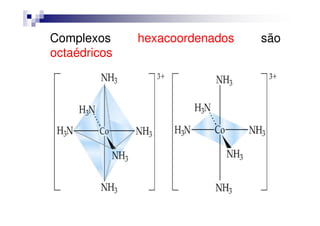
Exemplo de um complexo é o
[Co(NH ) ]3+, no qual o íon Co3+ está[Co(NH3)6]3+, no qual o íon Co3+ está
rodeado por seis ligantes NH3.
OBS!!! Este complexo será melhor explicado
a seguir com a definição de alguns
conceitos importantes.](https://image.slidesharecdn.com/aula16-140512225745-phpapp02/85/Aula16-3-320.jpg)






![O [Co(en)3]3+ octaédrico é um complexo
de etilenodiamina típico.](https://image.slidesharecdn.com/aula16-140512225745-phpapp02/85/Aula16-15-320.jpg)
![NN
CC
CoCo
Complexo Octaédrico [Co(en)3]3+
CoCo](https://image.slidesharecdn.com/aula16-140512225745-phpapp02/85/Aula16-16-320.jpg)
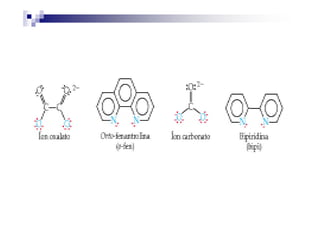
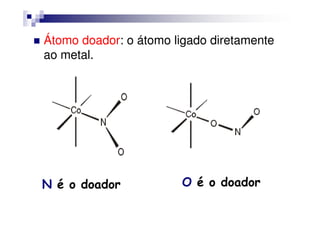
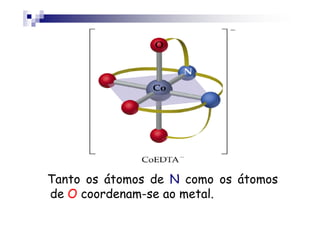
![Um agente quelante muito importante é o
etilenodiaminotetraacetato (EDTA4-).
O EDTA ocupa 6 sítios de coordenação,
por exemplo, [CoEDTA]- é um complexo
octaédrico Co3+.octaédrico Co3+.
O EDTA é usado em produtos de
consumo para complexar os íons metálico
que catalisam reações de decomposição.](https://image.slidesharecdn.com/aula16-140512225745-phpapp02/85/Aula16-19-320.jpg)

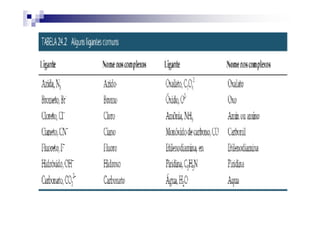
![1. Para os sais, dê nome primeiramente ao
ânion antes do cátion precedido da
preposição “de”.
Exemplo em [Co(NH3)5Cl]Cl2 damos nomeExemplo em [Co(NH3)5Cl]Cl2 damos nome
ao Cl- antes do [Co(NH3)5Cl]2+
TemosTemos aquiaqui oo cloretocloreto dede ........................](https://image.slidesharecdn.com/aula16-140512225745-phpapp02/85/Aula16-22-320.jpg)

![Exemplo: [Co(NH3)5Cl]2+ é amino e cloro
No entanto, são 5 amino: pentaamino
Observe que a parte penta é um indicaçãoObserve que a parte penta é um indicação
do número de grupos NH3 e
conseqüentemente não é considerada na
ordem alfabética dos ligantes.](https://image.slidesharecdn.com/aula16-140512225745-phpapp02/85/Aula16-25-320.jpg)
![4. O estado de oxidação do metal é dado
em números romanos entre parênteses
no final do nome do complexo.
[Co(NH ) Cl]2+[Co(NH3)5Cl]2+
Cobalto (III)](https://image.slidesharecdn.com/aula16-140512225745-phpapp02/85/Aula16-26-320.jpg)
![[Co(NH3)5Cl]Cl2
Cloreto de pentaaminoclorocobalto (III)Cloreto de pentaaminoclorocobalto (III)](https://image.slidesharecdn.com/aula16-140512225745-phpapp02/85/Aula16-27-320.jpg)
![5. Prefixos gregos são usados para indicar
o número de ligantes (di-, tri-, tetra-,
penta- e hexa-).
Coloque então o nome do ligante entre
parênteses e use bis-, tris-, tetrakis-,parênteses e use bis-, tris-, tetrakis-,
pentakis- e hexakis.
Exemplo [Co(en)3]Cl3 é o cloreto de
tris(etilenodiamino) cobalto(III).](https://image.slidesharecdn.com/aula16-140512225745-phpapp02/85/Aula16-28-320.jpg)

![A cor de um complexo depende: do metal e
de seu estado de oxidação.
O [Cu(H2O)6]2+ azul claro pode ser
convertido em [Cu(NH3)6]2+ azul escuro
com a adição de NH3.com a adição de NH3.
Geralmente necessita-se de um orbital d
parcialmente preenchido para que um
complexo seja colorido. Logo, íons
metálicos d0 normalmente são incolores.](https://image.slidesharecdn.com/aula16-140512225745-phpapp02/85/Aula16-30-320.jpg)

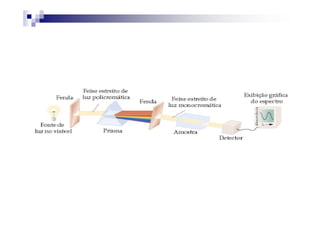
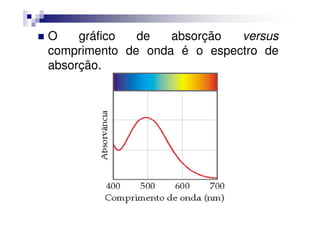
![Por exemplo, o espectro de absorção para
o [Ti(H2O)6]3+ tem uma absorção máxima
em 510 nm (verde e amarelo).
Logo, o complexo transmite toda a luz,
exceto a verde e a amarela.exceto a verde e a amarela.
Portanto o complexo é violeta](https://image.slidesharecdn.com/aula16-140512225745-phpapp02/85/Aula16-34-320.jpg)