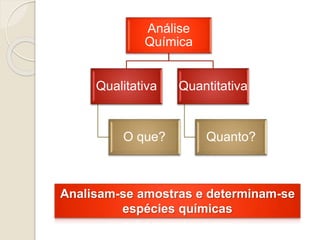
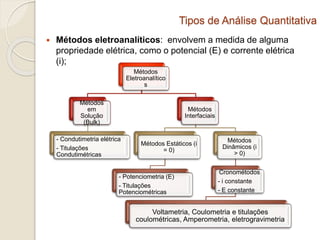
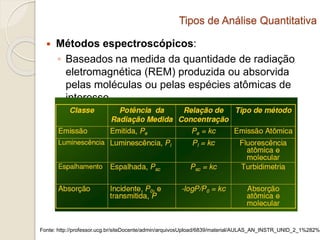
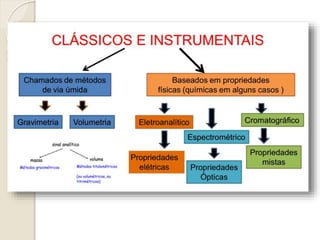
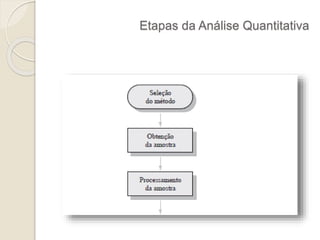
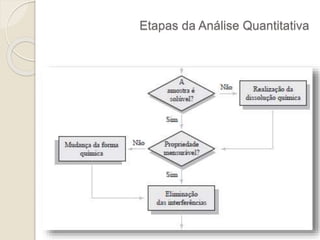
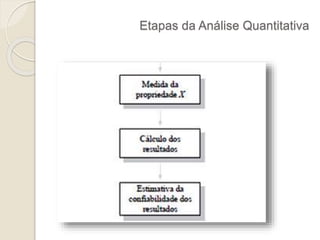
O documento discute os fundamentos da análise química quantitativa, definindo analito e amostra e descrevendo os principais tipos de análise quantitativa como gravimétrica, volumétrica e espectroscópica. Também aborda as etapas de uma análise quantitativa e a expressão dos resultados analíticos.