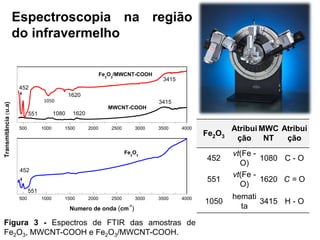
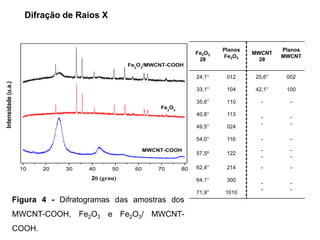
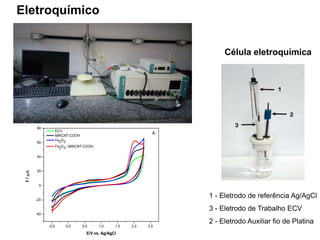
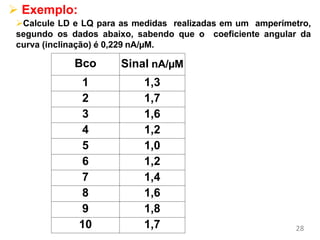
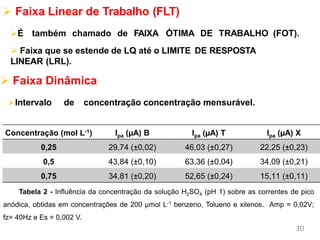
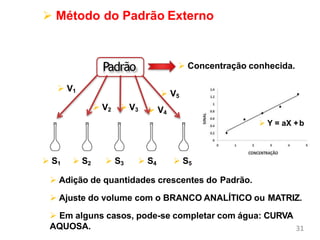
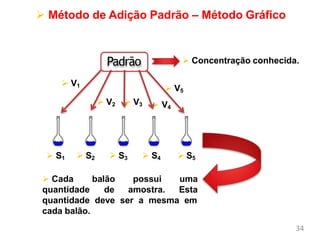
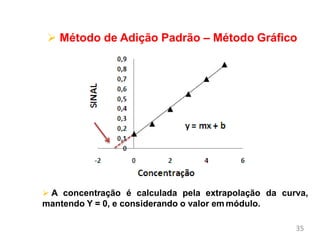
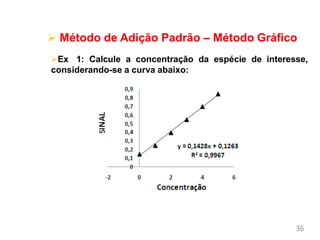
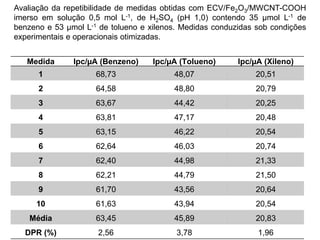
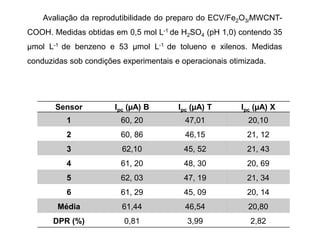
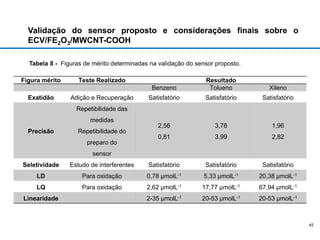
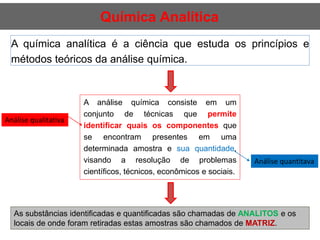
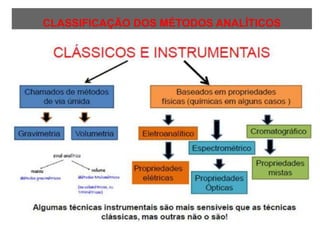
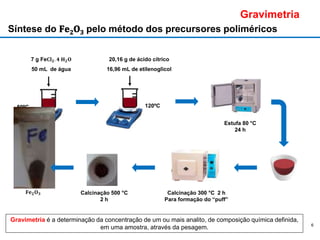
O documento discute fundamentos de análise instrumental em química analítica. Apresenta os principais tipos de análise qualitativa e quantitativa e classifica os métodos analíticos em clássicos e instrumentais. Descreve técnicas como eletroquímica, espectroscopia, difração de raios-X e microscopia eletrônica aplicadas à caracterização de compósitos de óxido de ferro.





![10
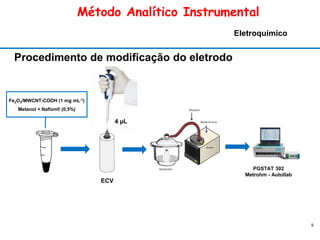
Avaliação da área eletroquimicamente ativa
Figura 1 - Voltamogramas cíclicos do ECV e ECV/Fe2O3/MWCNT-COOH obtidos na presença de
1x10-3 mol L-1 de K3[Fe(CN)6].
0.0 0.1 0.2 0.3 0.4 0.5 0.6
-12
-8
-4
0
4
8
12
0,0891cm
2
0,0659 cm
2
ECV
ECV/Fe2
O3/ MWCNT-COOH
I
/
A
E/V vs. Ag/AgCl](https://image.slidesharecdn.com/1aula-240124202357-93286db9/85/1-aula-pptx-10-320.jpg)