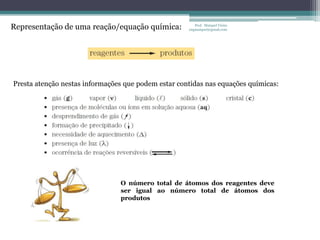
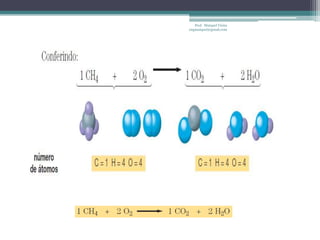
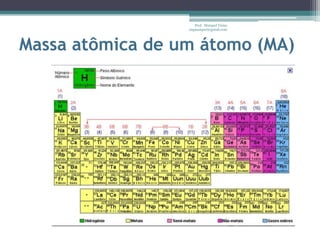
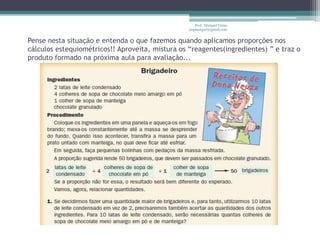
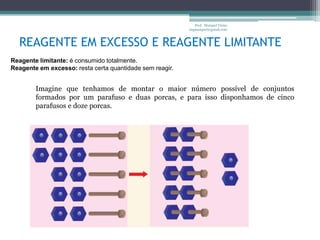
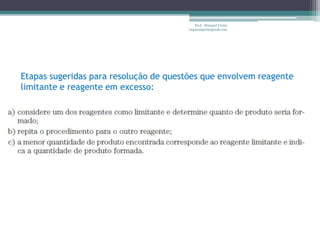
Este documento fornece informações sobre representação de reações químicas, cálculos estequiométricos, massa molar, mol, quantidade de substância, leis das reações químicas, reagente limitante, rendimento de reações e bibliografia sobre química geral. O documento discute conceitos-chave da química como equações químicas, massa atômica, massa molecular e aplicações desses conceitos em cálculos químicos.