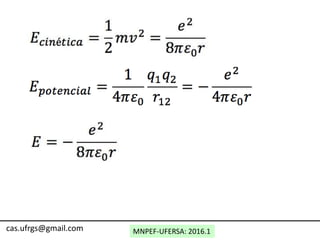
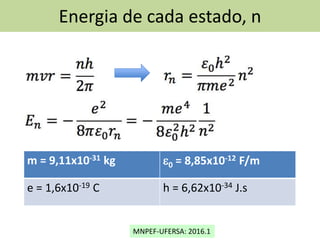
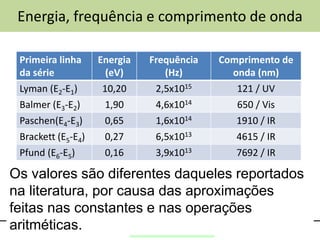
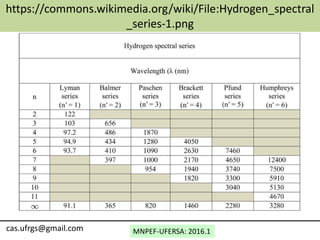
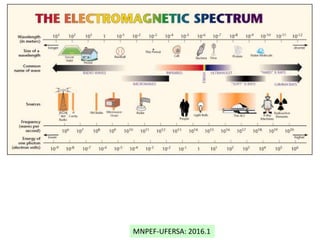
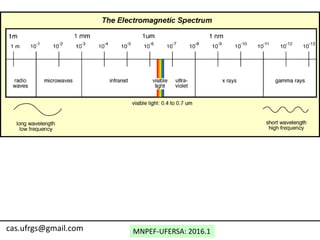
O documento discute o modelo atômico de Bohr, incluindo:
1) Os postulados de Bohr sobre as órbitas estáveis dos elétrons e o momento angular quantizado.
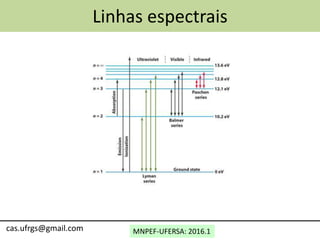
2) As linhas espectrais de hidrogênio (Lyman, Balmer, etc.) e suas energias, frequências e comprimentos de onda.
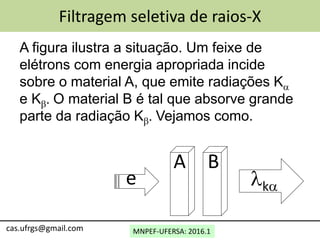
3) A aplicação do modelo de Bohr para prever espectros de raios-X de átomos com número atômico maior que hidrogênio.