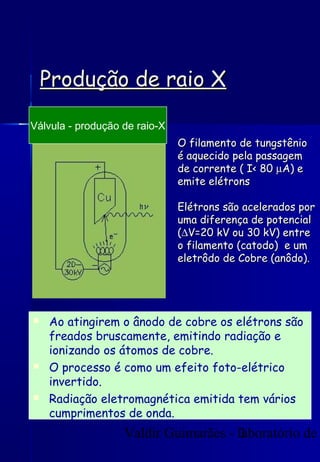
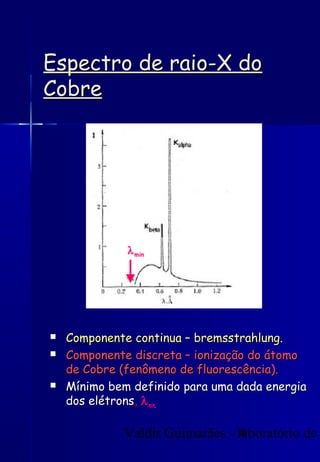
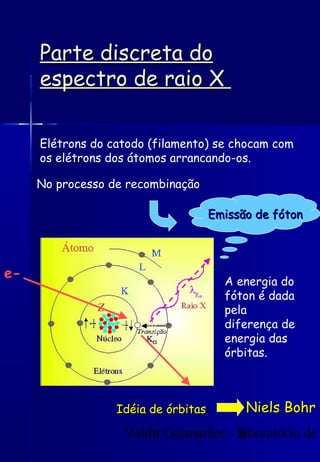
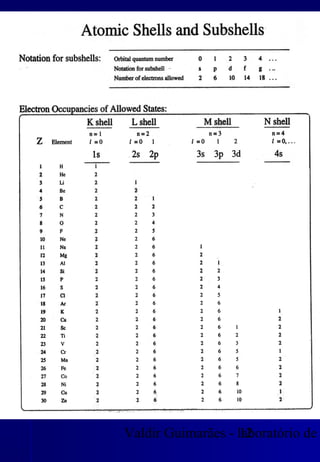
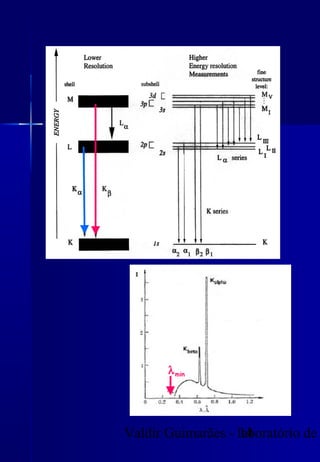
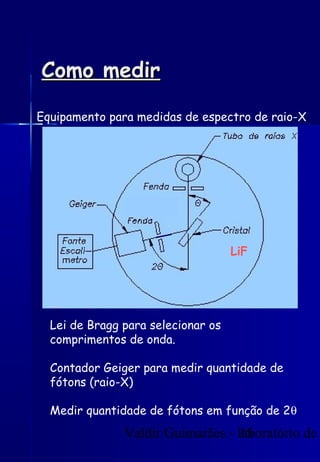
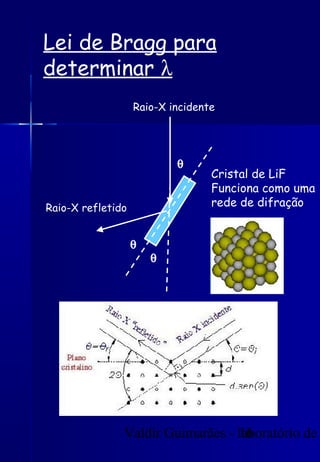
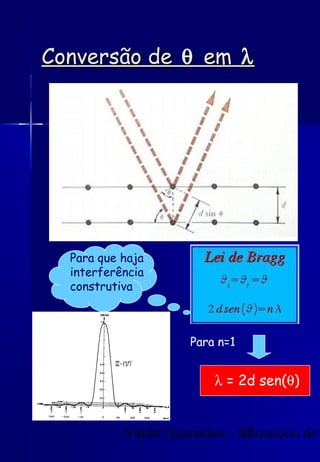
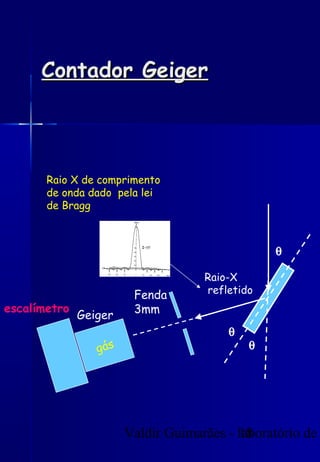
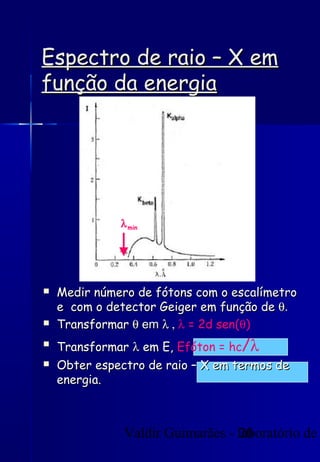
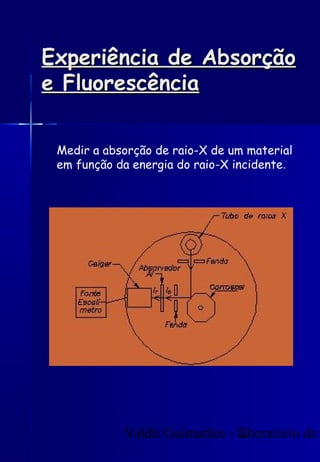
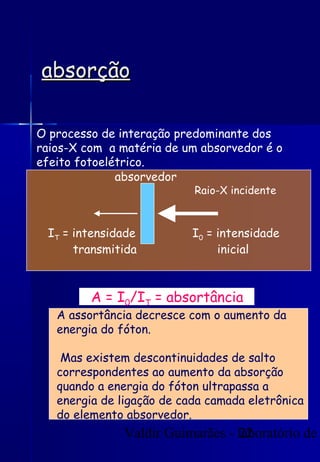
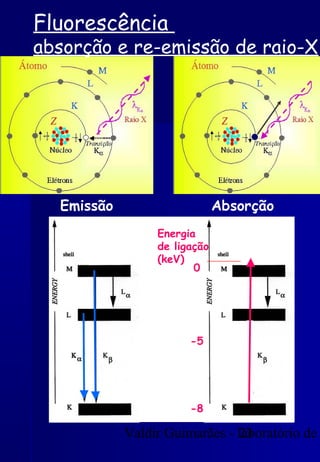
Os raios X foram descobertos acidentalmente em 1895 e desde então têm sido amplamente utilizados na medicina e na inspeção de cargas. O documento detalha a produção de raios X, o espectro resultante, e a interação dos raios X com a matéria, destacando processos como ionização e fluorescência. Também aborda aspectos quânticos, números quânticos, e métodos de medição, incluindo o uso de contadores Geiger e a lei de Bragg.