Incorporar apresentação
Baixado 114 vezes


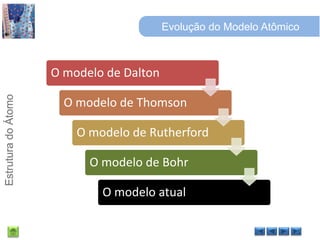
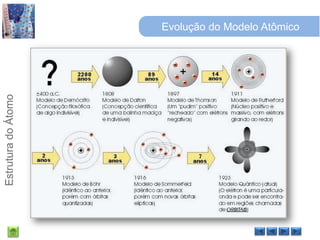
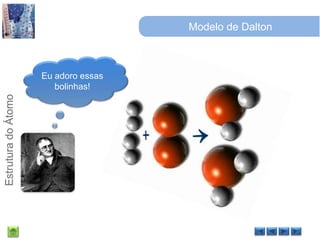
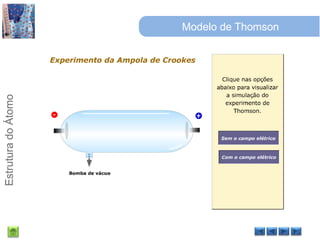
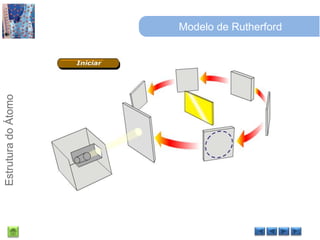
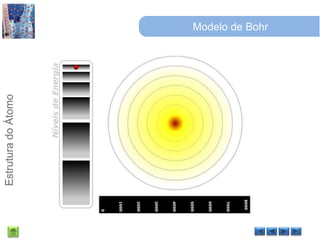

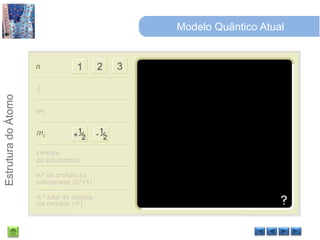
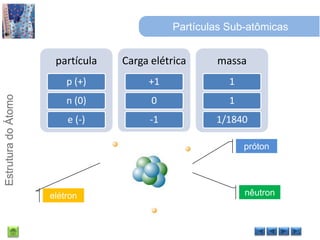


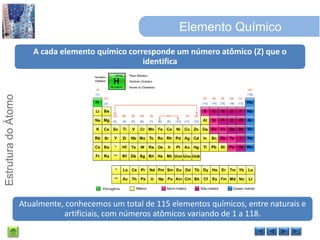

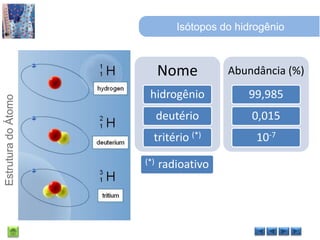

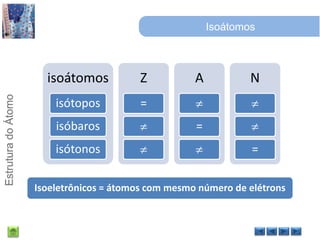
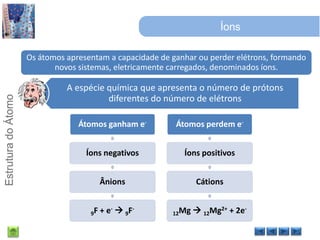
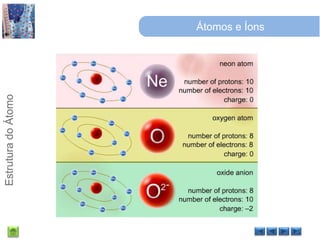



O documento discute a estrutura do átomo, começando com a evolução do modelo atômico desde a Grécia antiga até o modelo quântico atual. Detalha as partículas subatômicas como prótons, nêutrons e elétrons e conceitos como número atômico, número de massa e isótopos.






















