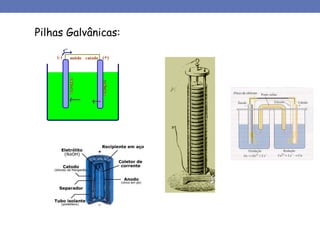
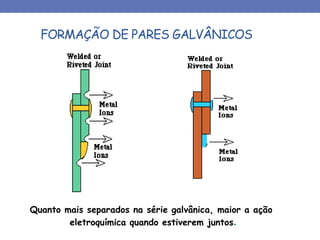
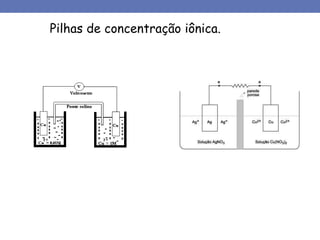
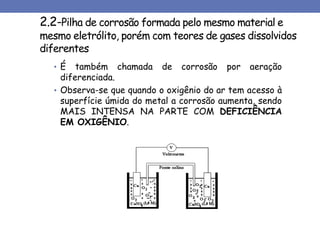
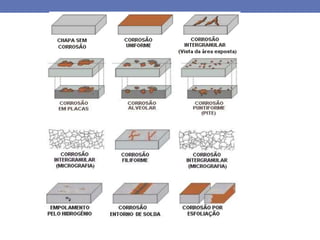
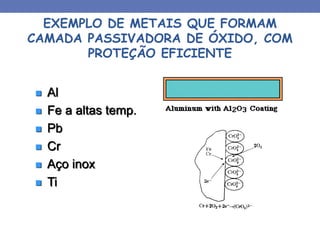
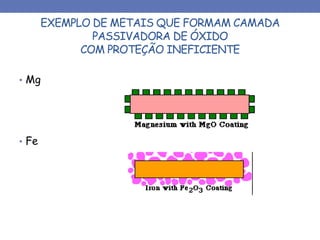
1. O documento descreve os principais tipos de pilhas ou células eletroquímicas que podem causar corrosão, incluindo pilhas galvânicas formadas por materiais químicos diferentes, e pilhas formadas pelo mesmo material em diferentes concentrações de eletrólitos.
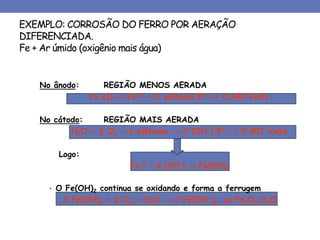
2. São descritos os mecanismos químico e eletroquímico da corrosão, assim como exemplos como a oxidação seca pelo ar.
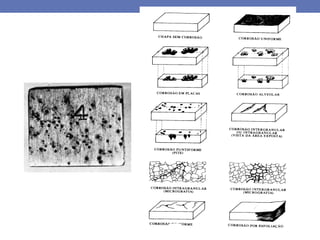
3. São apresentados os principais produtos da corrosão e reações nas áreas cat