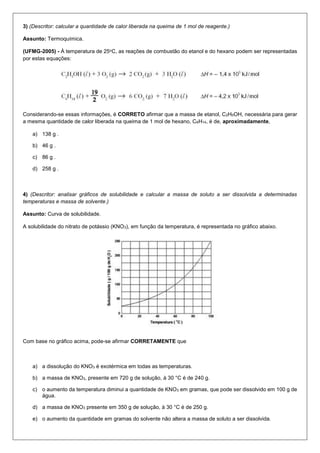
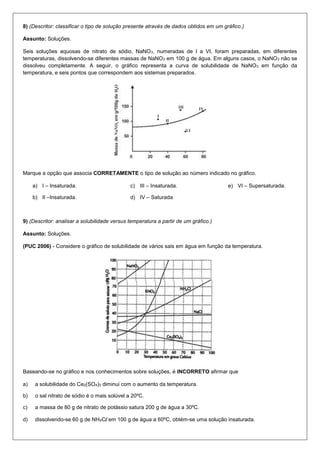
O documento contém 10 questões sobre conceitos de química como diluição de soluções, solubilidade, cálculo de volume em CNTP e concentração de soluções. As questões abordam cálculos envolvendo dados apresentados em gráficos, equações químicas e informações sobre a composição de diferentes substâncias.