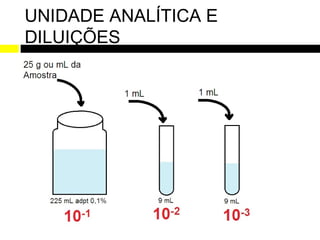
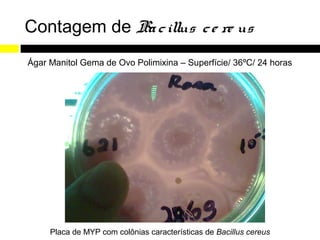
Este relatório de estágio descreve as atividades realizadas no Laboratório de Análises Microbiológicas e Físico-Químicas de Alimentos e Água (LAMAG) da UTFPR entre maio e novembro de 2011. O estágio teve como objetivos gerais desenvolver habilidades do estudante e ampliar seu conhecimento na área, e objetivos específicos como receber amostras, preparar meios de cultura, realizar análises microbiológicas e físico-químicas, e limpar equipamentos.