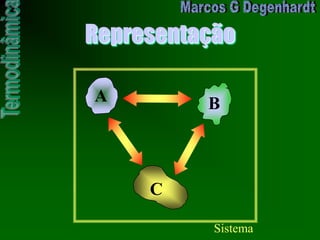
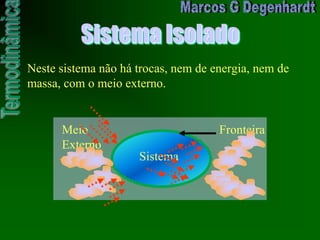
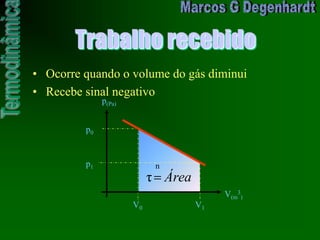
O documento introduz conceitos básicos de termodinâmica, como sistema, fronteira, estado termodinâmico, trabalho, energia e calor. Explica que a primeira lei da termodinâmica estabelece que a energia do universo é constante, e que a energia não pode ser criada ou destruída, apenas transformada de uma forma para outra.






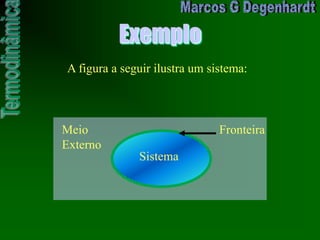

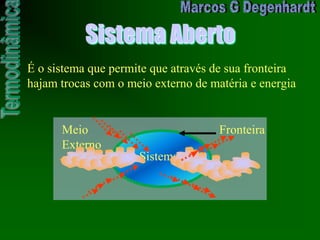
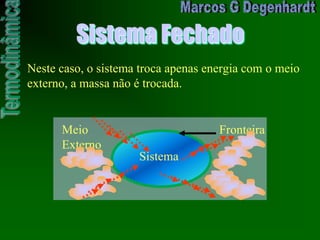















![Medidas
Uma quantidade de calor pode ser medida de duas
formas: a do Sistema Internacional ou por uma unidade
prática.
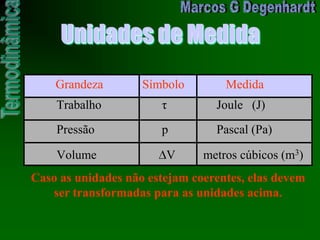
Medida Unidade
Sistema Internacional Joule [J]
sistema prático Caloria [cal]
J186,4cal1](https://image.slidesharecdn.com/aptermodinamica-140310225019-phpapp02/85/Ap-termodinamica-29-320.jpg)