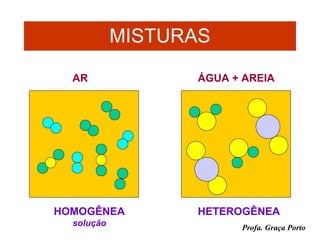
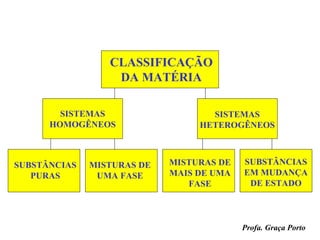
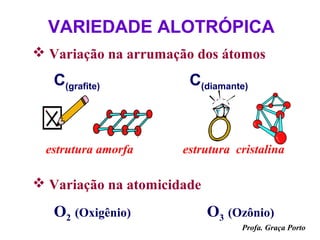
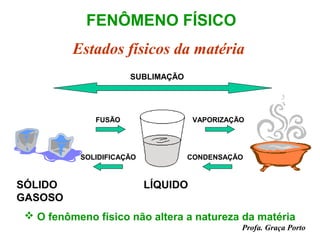
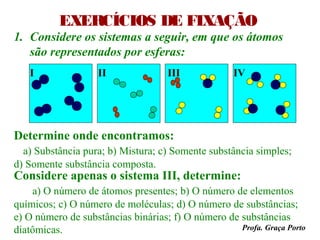
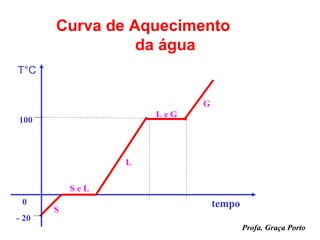
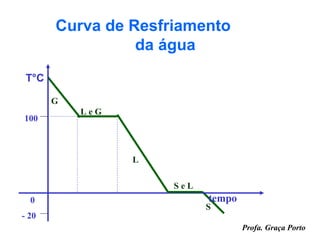
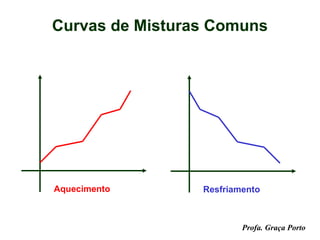
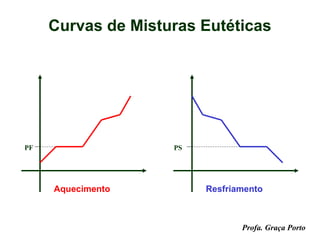
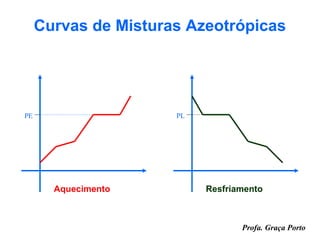
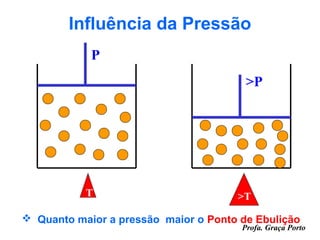
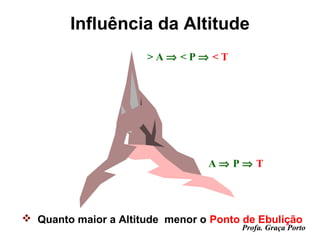
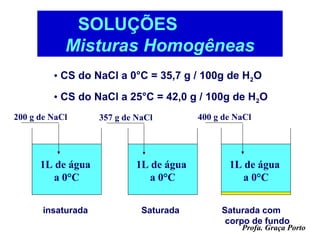
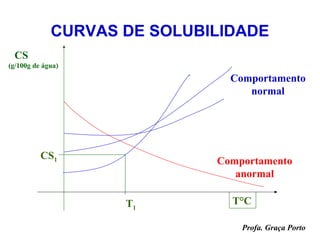
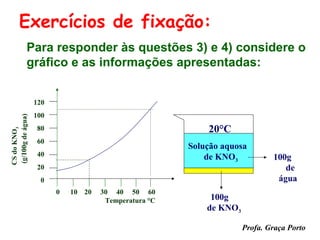
O documento fornece uma introdução sobre química, abordando tópicos como:
1) Uma definição de química como a ciência que estuda a estrutura, composição e transformação da matéria.
2) Uma explicação do método científico e como ele é aplicado na química e na tecnologia.
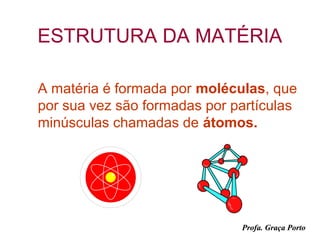
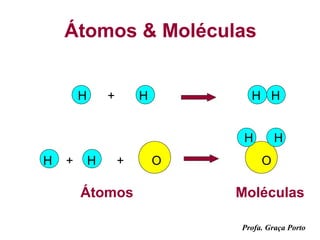
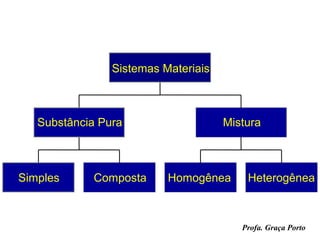
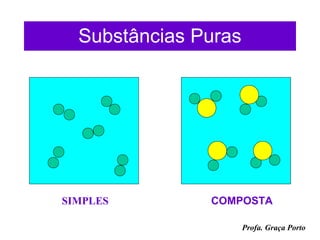
3) Informações sobre a estrutura da matéria, elementos químicos, átomos e moléculas.