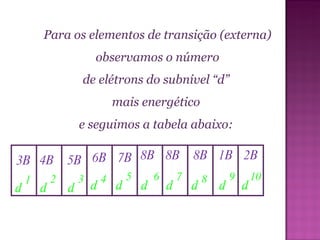
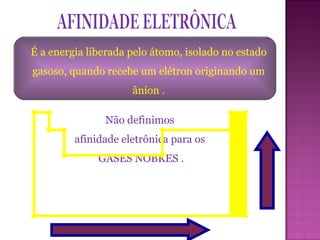
Este documento descreve a classificação periódica dos elementos químicos, incluindo sua organização em períodos e famílias com base em sua configuração eletrônica. Explica como propriedades como o tamanho atômico, potencial de ionização e eletronegatividade variam periodicamente de acordo com a posição do elemento na tabela periódica.