Nesta primeira aula, você vai acompanhar a evolução da Química, desde tempos imemoriais até o ponto em que ela se tornou uma ciência exata, descrevendo como os homens da Pré-história já utilizavam materiais químicos e como a teoria do flogisto, desenvolvida entre os séculos XVI e XVIII, representou um avanço no entendimento das transformações químicas, mas ainda não estabelecia a Química como uma ciência exata.
















































































































































![c) Átomos com mais do que o octeto
10
Este é, de longe, o caso mais importante e mais freqüente de
AULA
violação da regra do octeto. Ocorre quando o átomo central pertence
aos períodos mais altos da Tabela Periódica (do terceiro em diante).
A possibilidade de elétrons estarem em (ou ocuparem) orbitais d ou f
permite que a última camada do átomo central possa ser completada
com mais de oito elétrons. Essa situação é comum em compostos nos
quais o átomo central é um elemento de transição; ocorre também em
compostos formados entre os não-metais, desde que existam elétrons d
ou f na camada de valência, ou orbitais d ou f que possam ser ocupados
nessa camada.
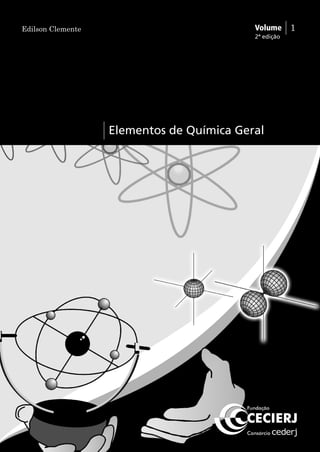
Como exemplo ilustrativo, vamos considerar o íon [ClF4]-.
O átomo central (Cl) é um não-metal (sendo também um elemento
representativo), mas pertence ao terceiro período da Tabela Periódica.
Sua camada de valência contém orbitais d (que não são ocupados no
átomo de Cl neutro e isolado). Assim, há a possibilidade do número de
elétrons ao redor do Cl ultrapassar o octeto.
Você pode verificar que existem 36 elétrons de valência nessa
espécie. Ao ligar o átomo de Cl aos de F e completar os octetos destes,
ficamos com a seguinte estrutura:
Observe que o octeto do Cl já está completo, mas sobram ainda
quatro elétrons. Estes são arrumados em pares em torno do átomo
central, gerando a estrutura a seguir:
C E D E R J 149](https://image.slidesharecdn.com/elementosdequmicageralvol1-110921154716-phpapp01/85/Quimica-Geral-1-CEDERJ-151-320.jpg)
![Elementos de Química Geral | Estruturas de Lewis: Parte II
ATIVIDADE
4. Em quais espécies a seguir a regra do octeto poderá não ser obedecida?
Justifique sua resposta:
a. C2H5OH;
b. SF4
c. CF2Cl2
d. [Fe(CN)4]2-
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
_________________________________________________________________
RESPOSTA COMENTADA
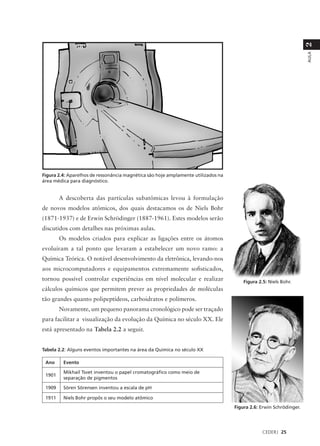
Das espécies citadas, três contêm elementos do terceiro período da
Tabela Periódica: SF4 (contém S), CF2Cl2 (contém Cl) e [Fe(CN)4]2-
(contém Fe). Entretanto, o átomo de Cl não é o átomo central no
CF2Cl2 ; seu octeto não vai ser ultrapassado. Já S é o átomo central
no SF4 , e Fe no [Fe(CN)4]2-. Portanto, é possível que os octetos do
S e do Fe sejam ultrapassados. Você pode verificar se isto vai ou
não ocorrer montando as estruturas de Lewis para estas espécies,
que são:
Observe que, nos dois casos, o octeto do átomo central é
ultrapassado.
CONCLUSÃO
A base da representação de uma estrutura de Lewis é a regra do
octeto. Há casos, porém, em que essa regra é violada; e outros, em que
uma só estrutura não descreve adequadamente o composto químico.
150 C E D E R J](https://image.slidesharecdn.com/elementosdequmicageralvol1-110921154716-phpapp01/85/Quimica-Geral-1-CEDERJ-152-320.jpg)